文章信息
- 李雪梅, 刘源, 乔乐天, 王子亮, 方明
- LI Xuemei, LIU Yuan, QIAO Letian, WANG Ziliang, FANG Ming
- 炙甘草汤调控SIRT1/PGC-1α通路改善CCl4致小鼠急性肝损伤的作用机制
- Mechanism of Fried glycyrrhizae decoction in improving CCl4 induced acute liver injury in mice by regulating the SIRT1/PGC-1α pathway
- 天津中医药大学学报, 2025, 44(3): 226-232
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(3): 226-232
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.03.06
-
文章历史
收稿日期: 2024-12-10
2. 商丘医学高等专科学校药理学教研室, 商丘 476002
2. Department of Pharmacology, Shangqiu Medical College, Shangqiu 476002, China
急性肝损伤是由于药物中毒、病毒感染、免疫反应等原因引发的肝功能异常及肝细胞损伤[1]。目前急性肝损伤有多种建模方式,但四氯化碳(CCl4)构建小鼠急性肝损伤模型因其造模效果较佳、操作要求低但重复性高而被广泛认可、应用[2]。急性肝损伤目前尚无有效的治疗方法,多数患者会发展为肝纤维化、肝癌,甚至威胁其生命[3]。研究发现中药作为近年来研究的热点,在治疗肝损伤中疗效显著,如姜黄[4]。急性肝损伤的临床症状多为食欲不振、身目黄染、胁痛等,故中医认为急性肝损伤属于黄疸、胁痛等范畴,其病因在于外感药毒之邪,或先天禀赋不足,或机体正气亏虚,其治疗方法应以滋阴补肾、疏肝理气、补血活血及调和肝脾为宗旨[5-6]。炙甘草汤由多种药物构成,如炙甘草、生姜、人参、桂枝、麻仁、麦冬等,为甘温之润剂,其中炙甘草可益气滋阴、补脾和胃、通阳复脉;人参可滋补肝肾、生津养血;阿胶、大枣具有滋阴补血的功效;桂枝性温、甘,具有杀菌抗病毒、滋而不腻、消炎止痛等多种药理作用;生姜、麦冬具有镇痛抗炎、抗氧化、提高免疫力、抗癌等作用,单味药的药理作用应用广泛,使得该汤药在多种疾病中被研究[7-9],但其在急性肝损伤中研究甚少[10]。据报道氧化应激、炎症反应往往参与CCl4建立的急性肝损伤[11]。沉默信息调节因子1(SIRT1)是一种组蛋白脱乙酰酶,过氧化物酶体增殖物激活受体γ共激活剂-1α(PGC-1α)是SIRT1的下游靶标,在各种疾病中起着关键作用,包括氧化应激、衰老和炎症[12],且已有研究表明SIRT1/PGC-1α通路是治疗肝损伤的潜在靶点[13]。同时,激活SIRT1/PGC-1α通路有助于减轻药物诱导的肝损伤[14]。鉴于此,本研究旨在探讨炙甘草汤对CCl4导致小鼠急性肝损伤的影响及相关作用机制。
1 材料 1.1 动物北京斯贝福生物技术有限公司提供70只C57BL/6 J雄性小鼠[体质量(20±3)g,7周龄,SPF级],许可证号:SCXK(京)2019-0010。小鼠饲养在合适的湿度、温度的SPF级动物房中,12 h光照/12 h明暗交替循环,自由饮水、进食,该研究已获得动物护理和使用委员会的批准(202306008)。
1.2 药物与试剂北京德寿堂药房提供炙甘草、麦冬、麻仁、阿胶、桂枝、生地黄等炙甘草汤组方,小火浓煎至生药含量3 g/mL;上海源叶生物科技有限公司提供SIRT1抑制剂sirtinol(批号S80707);上海士锋生物科技有限公司提供奥贝胆酸(批号20052315);建成生物工程研究所提供白细胞介素(IL)-6(批号20220105)、丙二醛(MDA)(批号20100813)、肿瘤坏死因子-α(TNF-α)(批号20220120)、丙氨酸氨基转移酶(ALT)(批号20190120)、超氧化物歧化酶(SOD)(批号20100811)、天冬氨酸氨基转移酶(AST)(批号20190110)试剂盒;Abcam公司提供SIRT1(批号ab110304)、PGC-1α(批号ab176328)一抗。
1.3 仪器美国BioTek公司提供Epoch长酶标仪;Leica公司提供光学显微镜;美国Scilogex公司提供D3024R离心机。
2 方法 2.1 实验小鼠干预、分组及模型构建喂养1周的C57BL/6 J小鼠随机分为对照组、CCl4组、炙甘草汤低、中、高(炙甘草汤-L、炙甘草汤-M、炙甘草汤-H)剂量组、炙甘草汤-H+sirtinol组、奥贝胆酸组,每组10只。其中对照组以10 mL/kg橄榄油腹腔注射,其余各组以10 mL/kg 0.1% CCl4腹腔注射进行构建急性肝损伤[15],禁食24 h后,炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组分别给予2 mL/kg、4 mL/kg、8 mL/kg的炙甘草汤灌胃干预[16];炙甘草汤-H+sirtinol组给予8 mL/kg的炙甘草汤灌胃干预同时,尾部静脉注射2 mg/kg sirtinol干预[17];奥贝胆酸组以30 mg/kg奥贝胆酸灌胃干预[18];对照组、CCl4组分别给予等体积的生理盐水干预,每天干预1次。
2.2 小鼠一般状况观察小鼠饮食、精神状态;造模完成后16 h,麻醉小鼠,采集血液,并分离小鼠肝脏,观察颜色及质地。
2.3 检测小鼠肝功能造模完成后16 h,腹腔注射巴比妥钠麻醉小鼠,仰卧位固定在操作板上,右手持采血管,从眼眶内侧(靠近鼻侧)轻轻插入,将采集血液迅速注入无菌离心管中,离心半径15 cm,以3 000 r/min离心10 min,用移液器小心吸取血清,按照试剂盒步骤检测AST、ALT水平。
2.4 检测小鼠血清中炎症因子水平取2.3中血清样本,酶联免疫吸附实验(ELISA)检测血清中TNF-α、IL-6水平。
2.5 检测小鼠肝脏组织中氧化应激水平收集小鼠部分肝脏组织,并进行组织匀浆,检测肝脏组织中MDA、SOD水平。
2.6 检测肝脏组织病理学变化用生理盐水清洗小鼠部分肝脏,并用10%中性福尔马林固定,并将组织脱钙、包埋在石蜡中,切成厚度约4 μm切片,将切片用二甲苯脱蜡,梯度酒精水合、苏木精-伊红(HE)溶液、天狼猩红染色,光镜下观察肝脏组织病理学变化。
2.7 SIRT1/PGC-1α通路相关蛋白表达收集小鼠部分肝脏组织,将组织剪成小块,加入适量的预冷放射免疫沉淀实验裂解液,使用匀浆器在冰上匀浆、裂解,裂解后的样品离心,用移液器小心吸取上清液,并测定其浓度,经电泳分离、转模后进行封闭,随后加入SIRT1、PGC-1α一抗孵育过夜,之后以二抗孵育、增强化学发光试剂曝光显影,Image J软件分析灰度值。
2.8 统计学方法采用SPSS 27.0软件分析实验数据,P < 0.05时,认为差异有统计学意义。数据以均数±标准差(x ± s)表示,单因素方差分析用于多组间比较,符合正态分布和方差齐性,以SNK-q检验进一步两两比较。
3 结果 3.1 炙甘草汤对各组小鼠一般状况影响对照组小鼠活动量正常,皮毛光泽,精神状态较佳,肝脏光滑,无颗粒感,呈鲜红色;CCl4组小鼠精神涣散,慵懒,皮毛无光泽,肝脏粗糙,呈暗红色;炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、炙甘草汤-H+sirtinol组、奥贝胆酸组小鼠状态及肝脏外观得到改善,见图 1。
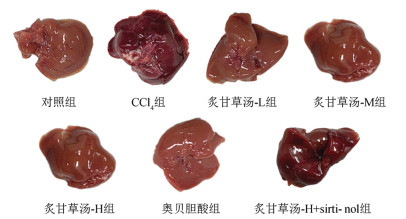
|
| 图 1 各组小鼠肝脏外观变化 |
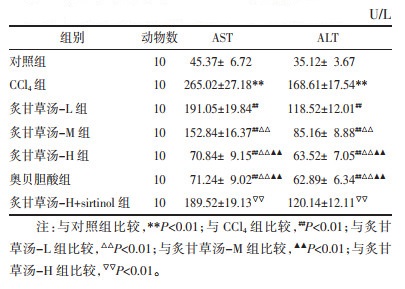
与对照组相比,CCl4组血清中AST、ALT水平增加(P < 0.01);与CCl4组相比,炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组血清中AST、ALT水平降低,不同浓度炙甘草汤差异具有统计学意义(P < 0.01),但炙甘草汤-H组与奥贝胆酸组无差异(P > 0.05);与炙甘草汤-H组相比,炙甘草汤-H+sirtinol组血清中AST、ALT水平增加(P < 0.01),见表 1。
与对照组相比,CCl4组血清中TNF-α、IL-6水平增加(P < 0.01);与CCl4组相比,炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组血清中TNF-α、IL-6水平降低,不同浓度炙甘草汤具有统计学差异(P < 0.01),但炙甘草汤-H组与奥贝胆酸组无差异(P > 0.05);与炙甘草汤-H组相比,炙甘草汤-H+sirtinol组血清中TNF-α、IL-6水平增加(P < 0.01),见表 2。
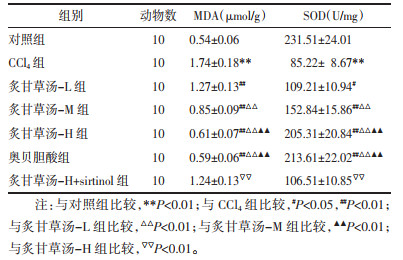
与对照组相比,CCl4组肝脏组织MDA增加,SOD降低(P < 0.01);与CCl4组相比,炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组肝脏组织MDA降低,SOD增加,不同浓度炙甘草汤具有统计学差异(P < 0.05),但炙甘草汤-H组与奥贝胆酸组无差异(P > 0.05);与炙甘草汤-H组相比,炙甘草汤-H+sirtinol组肝脏组织MDA增加,SOD降低(P < 0.01),见表 3。
对照组小鼠结构完整,细胞结构清晰、排列有序,无炎性浸润;CCl4组细胞出现坏死及炎性浸润;炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组细胞逐渐排列有序,肝损伤程度降低,以炙甘草汤-H组、奥贝胆酸组炎性浸润、细胞坏死等改善最为明显;炙甘草汤-H+sirtinol组细胞肿胀、浸润较炙甘草汤-H组严重,见图 2。
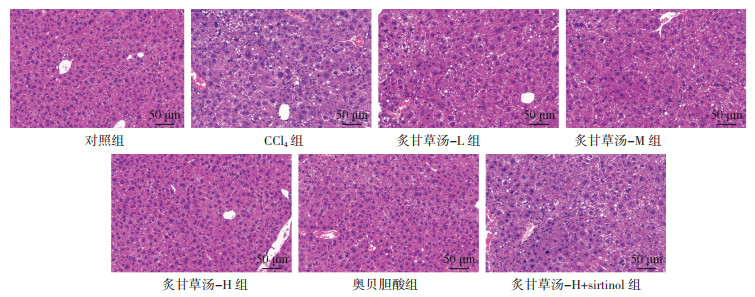
|
| 图 2 肝组织病理学变化(HE,×200) |
对照组小鼠肝小叶结构完整;CCl4组有胶原纤维增生产生,肝小叶被破坏;炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组胶原沉积得到改善,以炙甘草汤-H组、奥贝胆酸组改善最为明显;炙甘草汤-H+sirtinol组胶原沉积程度较炙甘草汤-H组严重,见图 3。
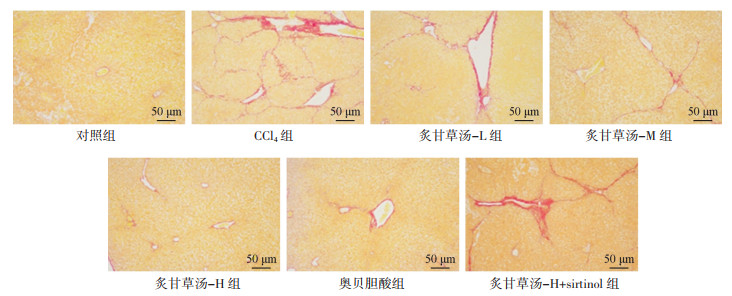
|
| 图 3 肝组织病理学变化(天狼猩红,×200) |
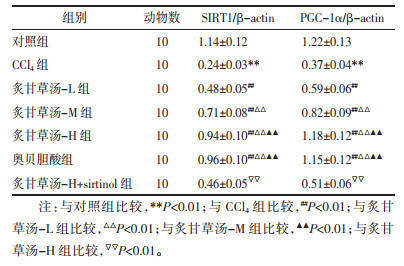
与对照组相比,CCl4组SIRT1、PGC-1α表达降低(P < 0.01);与CCl4组相比,炙甘草汤-L、炙甘草汤-M、炙甘草汤-H组、奥贝胆酸组SIRT1、PGC-1α表达增加,不同浓度炙甘草汤具有统计学差异(P < 0.01),但炙甘草汤-H组与奥贝胆酸组无差异(P > 0.05);与炙甘草汤-H组相比,炙甘草汤-H+sirtinol组SIRT1、PGC-1α表达降低(P < 0.01),见图 4、表 4。

|
| 注:A,对照组;B,CCl4组;C,炙甘草汤-L组;D,炙甘草汤-M组;E,炙甘草汤-H组;F,奥贝胆酸组;G,炙甘草汤-H+sirtinol组。 图 4 肝组织中SIRT1、PGC-1α蛋白表达 |
肝脏被认为是身体的重要器官,参与调节物质的生物转化和解毒[19]。CCl4是一种众所周知的肝毒素,可以通过氧化应激、炎症反应等多种机制诱导肝损伤,可用于药物治疗或开发[20]。急性肝损伤可发展成急性肝衰竭,预后差且病死率高[21],迄今为止,还没有发现治疗急性肝损伤的有效方法。
急性肝损伤的发生机制较为复杂,氧化应激被认为是CCl4诱导肝损伤的主要发病过程。当机体受到某些有害因素刺激时,过量的活性氧的产生导致氧化-抗氧化防御系统失衡,引发抗氧化酶SOD活性降低,同时脂质过氧化产物MDA增加。细胞炎性浸润发生,肝组织细胞损伤加剧,细胞膜通透性增加,ALT和AST可以大量释放到血液中[22]。当CCl4诱导急性肝损伤时,多种细胞被激活,引起促炎因子TNF-α的释放,可直接或间接地导致肝细胞坏死,其诱导IL-6的产生,又加重肝损伤的发生[23-24]。研究发现CCl4诱导的小鼠血清中肝功能指标AST、ALT水平与炎症因子TNF-α、IL-6水平明显增加,肝脏组织MDA显著增加,SOD水平降低,肝脏组织形态也出现明显的病理改变,这与LI等[25]研究的结果一致,提示CCl4诱导的小鼠肝功能异常,氧化应激及炎症反应明显增加。急性肝损伤的治疗应以调和肝脾、疏肝理气、扶正补虚为主,同时辅以清热药物[26],而炙甘草汤源自汉代张仲景的《伤寒论》,为补益剂,具有益气滋阴,通阳复脉之功效。主治阴血阳气虚弱,心脉失养证,其中生姜调和胃气、降逆止呕;炙甘草、大枣益气和中,扶正祛邪,在小柴胡汤中作为重要成分,发挥保护肝损伤的作用;而人参作为传统名贵中药,可以增强肝脏代谢酶活性以发挥解毒功能,具有抗肝损伤作用[27]。桂枝在助脾气上升的同时,与麦冬相配又可理肝气,诸药合用达到驱邪扶正、养阴益气等功效,且药理学研究表明该汤药具有抗氧化、抗炎以及提高免疫力的作用,副作用少、安全性高[28-29]。在乙型肝炎肝硬化腹水研究中[30],炙甘草汤联合猪苓汤治疗效果显著。研究发现,炙甘草汤干预后,小鼠肝功能得到改善,TNF-α、IL-6水平下降,肝脏组织MDA下降,SOD水平增高,肝组织损伤得到缓解,表明炙甘草汤可抑制肝组织的氧化应激反应和全身炎症,通过其抗氧化和抗炎作用改善CCl4诱导的急性肝损伤,未来需要进一步的临床研究来验证其疗效及机制。
肝损伤的主要致病基础是CCl4引发的炎症反应、氧化应激,因此治疗肝病的有效手段是抑制肝组织氧化应激及炎症反应[31]。线粒体是肝细胞中氧化代谢的主要场所和主要能量来源,参与维持肝功能,而氧化应激是大多数肝病的共同特征[32]。激活SIRT1信号可一定程度抑制氧化应激发生,抑制肝细胞凋亡,改善急性肝损伤,PGC-1α是SIRT1下游因子,是线粒体生物发生和功能以及氧化应激的关键调节因子[18, 33]。在乙醇诱导的肝损伤中,烟酰胺核苷提供激活SIRT1/PGC-1α通减少脂质积聚及线粒体生物合成,减轻肝组织受损[34]。化瘀祛痰方可抑制炎性反应,改善肝脏脂质沉积,与SIRT1/PGC-1α信号通路调节线粒体功能相关[35]。研究发现CCl4诱导的小鼠肝组织中SIRT1、PGC-1α表达降低,提示CCl4引发的肝损伤可能与SIRT1/PGC-1α通路被抑制有关。但经炙甘草汤干预后,SIRT1、PGC-1α表达上调,肝功能及损伤得到改善,推测炙甘草汤可能通过上调SIRT1/PGC-1α通路减轻CCl4引发的肝损伤。为进一步核验该机制,实验以SIRT1抑制剂-sirtinol进行验证,结果发现sirtinol逆转了炙甘草汤对CCl4引发的肝损伤的保护作用,表明炙甘草汤通过上调SIRT1/PGC-1α通路调节线粒体功能,抑制炎症反应和氧化应激,进而保护CCl4引发的肝损伤。
综上所述,炙甘草汤可能通过上调SIRT1/PGC-1α保护CCl4引发的肝损伤,可能与上调SIRT1/PGC-1α通路有关,但仍需进一步的研究来验证其具体机制和临床应用潜力。
| [1] |
HASSAN A, FONTANA R J. The diagnosis and management of idiosyncratic drug-induced liver injury[J]. Liver International, 2019, 39(1): 31-41. DOI:10.1111/liv.13931 |
| [2] |
李青青, 熊佳慧, 温玉清, 等. 丹参酮ⅡA对CCl4诱导小鼠急性肝损伤的保护作用[J]. 中国临床解剖学杂志, 2022, 40(6): 671-676. |
| [3] |
宋添力, 唐浪, 王一民, 等. 竹节参多糖通过PI3K/AKT/NF-κB信号通路对急性肝损伤大鼠的影响[J]. 精细化工, 2023, 40(11): 2472-2479. |
| [4] |
谢一潋, 杨乃彬, 王丽萍, 等. 姜黄素通过激活肝细胞自噬减轻脂多糖/D-氨基半乳糖诱导的大鼠急性肝损伤[J]. 中国病理生理杂志, 2020, 36(5): 860-864. DOI:10.3969/j.issn.1000-4718.2020.05.013 |
| [5] |
唐颖慧, 刘皎皎, 李粉萍, 等. 急性药物性肝损伤患者中医证候要素分布特征探讨[J]. 实用临床医药杂志, 2022, 26(7): 8-12. |
| [6] |
张志宏, 周俊发, 秦安琪, 等. 中药单体抗急性肝损伤的作用机制研究进展[J]. 中医药信息, 2023, 40(12): 70-74. |
| [7] |
周倩, 戴衍朋, 郭威, 等. 基于顶空-气相色谱-离子迁移谱的生、炙甘草饮片挥发性有机物指纹图谱分析[J]. 中国中药杂志, 2020, 45(16): 3857-3862. |
| [8] |
盛春瑞, 葛东宇, 王淑艳, 等. 炙甘草汤通过抗氧化抑制博莱霉素诱导的小鼠肺纤维化[J]. 现代生物医学进展, 2022, 22(21): 4014-4019. |
| [9] |
杨洁文, 徐叶峰, 严卿莹. 炙甘草汤干预阿霉素致大鼠心肌损害的能量代谢研究[J]. 浙江中医杂志, 2021, 56(4): 258-260. DOI:10.3969/j.issn.0411-8421.2021.04.010 |
| [10] |
周浩然, 李家立, 杨洁, 等. 经典名方炙甘草汤治疗心律失常的研究现状[J]. 中药药理与临床, 2023, 39(5): 123-128. |
| [11] |
郭伟, 胡田颖, 雷宏强, 等. 葛根-南五味子预防给药减轻四氯化碳致小鼠急性肝损伤[J]. 中药药理与临床, 2023, 39(11): 39-45. |
| [12] |
SU H L, MA Z S, GUO A X, et al. Salvianolic acid B protects against sepsis-induced liver injury via activation of SIRT1/PGC-1α signaling[J]. Experimental and Therapeutic Medicine, 2020, 20(3): 2675-2683. |
| [13] |
胡媛媛, 姜广建, 祝嘉健, 等. 藜麦复合物调控SIRT1/PGC-1α通路改善糖尿病小鼠肝细胞损伤[J]. 湖南中医药大学学报, 2021, 41(12): 1863-1868. DOI:10.3969/j.issn.1674-070X.2021.12.009 |
| [14] |
ÇOMAKLıS, ÖZDEMIR S, KÜÇÜKLER S, et al. Beneficial effects of quercetin on vincristine-induced liver injury in rats: Modulating the levels of Nrf2/HO-1, NF-kB/STAT3, and SIRT1/PGC-1α[J]. Journal of Biochemical and Molecular Toxicology, 2023, 37(5): e23326. DOI:10.1002/jbt.23326 |
| [15] |
郅音, 宋雅楠, 张苗, 等. 四氯化碳诱导的小鼠急性肝损伤药理作用研究[J]. 中华中医药学刊, 2022, 40(1): 17, 107-109. |
| [16] |
白雪峰, 万晓燕, 惠彩霞. 炙甘草汤对异丙肾上腺素诱导的心肌纤维化大鼠心肌NF-κB信号通路的调节作用研究[J]. 现代中西医结合杂志, 2021, 30(31): 3440-3446. DOI:10.3969/j.issn.1008-8849.2021.31.005 |
| [17] |
董莉, 杨燕玲, 郑钰凡, 等. 益心方调控SIRT1/PGC-1α信号通路改善大鼠心肌缺血再灌注损伤[J]. 上海中医药杂志, 2023, 57(7): 58-65. |
| [18] |
张艳蕾, 崔龙涛, 王琪瑶, 等. 食源性栀子方保护CC14诱导小鼠急性和亚急性肝损伤的机制[J]. 中国实验方剂学杂志, 2022, 28(18): 30-37. |
| [19] |
ULLAH H, KHAN A, BAIG M W, et al. Poncirin attenuates CCl4-induced liver injury through inhibition of oxidative stress and inflammatory cytokines in mice[J]. BMC Complementary Medicine and Therapies, 2020, 20(1): 115. DOI:10.1186/s12906-020-02906-7 |
| [20] |
王冬梅, 陈伟, 赵丹丹. 基于sirt1/FOXO1通路研究双氢青蒿素对CCl4诱导大鼠急性肝损伤的保护作用[J]. 热带医学杂志, 2022, 22(2): 160-164, 169. |
| [21] |
LI Y, GUO Z M, CUI H P, et al. Urantide prevents CCl4-induced acute liver injury in rats by regulating the MAPK signalling pathway[J]. Molecular Medicine Reports, 2021, 24(4): 688. |
| [22] |
HAN C Y, SUN T T, XV G P, et al. Berberine ameliorates CCl4-induced liver injury in rats through regulation of the Nrf2-Keap1-ARE and p53 signaling pathways[J]. Molecular Medicine Reports, 2019, 20(4): 3095-3102. |
| [23] |
符路娣, 李兆新, 潘卫松, 等. 甘草酸二铵联合丹参注射液对CCl4诱导小鼠急性肝损伤的保护作用[J]. 中药新药与临床药理, 2020, 31(7): 810-814. |
| [24] |
孙武, 周兵, 毛国梁, 等. 蛇床子素改善小鼠实验性肝损伤机制的研究[J]. 右江民族医学院学报, 2022, 44(5): 633-637. |
| [25] |
LI Q Y, YANG H L, WANG W X, et al. Brassica rapa polysaccharides ameliorate CCl4-induced acute liver injury in mice through inhibiting inflammatory apoptotic response and oxidative stress[J]. Chemistry & Biodiversity, 2020, 17(1): e1900534. |
| [26] |
朱正望, 苗明三, 朱平生. 基于数据挖掘的中医药治疗肝损伤临床用药规律研究[J]. 中药新药与临床药理, 2023, 34(2): 273-278. |
| [27] |
江一川, 郭旻宇, 吴雪记, 等. 人参及灵芝超微粉对四氯化碳所致小鼠急性肝损伤的影响[J]. 人参研究, 2018, 30(6): 2-4. |
| [28] |
CHEN R, CHEN T, WANG T Q, et al. Tongmai Yangxin pill reduces myocardial No-reflow via endothelium-dependent NO-cGMP signaling by activation of the cAMP/PKA pathway[J]. Journal of Ethnopharmacology, 2021, 267: 113462. |
| [29] |
WU Q Y, ZHANG Q Y, LI Y, et al. A systematic review and meta-analysis of high-frequency prescription of Zhigancao decoction combined with conventional western medicine in the treatment of chronic heart failure[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 7140044. |
| [30] |
李艳丽. 探讨炙甘草汤联合猪苓汤联合治疗乙型肝炎肝硬化腹水的临床效果[J]. 中文科技期刊数据库(全文版)医药卫生, 2022, 14(12): 169-172. |
| [31] |
刘丽红, 赵培佐, 王宇莲, 等. 维生素K2对四氯化碳诱导的急性大鼠肝损伤的保护作用[J]. 中国微生态学杂志, 2022, 34(4): 381-387. |
| [32] |
YANG F, PEI R N, ZHANG Z W, et al. Copper induces oxidative stress and apoptosis through mitochondria-mediated pathway in chicken hepatocytes[J]. Toxicology in Vitro, 2019, 54: 310-316. |
| [33] |
LIU B B, ZHANG J, SHAO L, et al. San-Huang-Chai-Zhu formula ameliorates liver injury in intrahepatic cholestasis through suppressing SIRT1/PGC-1α-regulated mitochondrial oxidative stress[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022: 7832540. |
| [34] |
WANG S F, WAN T, YE M T, et al. Nicotinamide riboside attenuates alcohol induced liver injuries via activation of SirT1/PGC-1α/mitochondrial biosynthesis pathway[J]. Redox Biology, 2018, 17: 89-98. |
| [35] |
陈怡然, 贾连群, 宋囡, 等. 化瘀祛痰方调节AMPK/SIRT1/PGC-1α信号通路抑制炎症小体活化改善AS小鼠肝脏脂质沉积的机制研究[J]. 中国中西医结合杂志, 2022, 42(10): 1213-1219. |
 2025, Vol. 44
2025, Vol. 44