文章信息
- 李博, 梁伟, 何新颖, 刘志龙, 杨欢, 鲁玉洁, 李梦, 孙云川
- LI Bo, LIANG Wei, HE Xinying, LIU Zhilong, YANG Huan, LU Yujie, LI Meng, SUN Yunchuan
- 安肠组方对放射性肠炎小鼠抗炎作用及肠道屏障功能的影响
- Effect of Anchang Group formula on anti-inflammatory effect and intestinal barrier function in mice with radiation enteritis
- 天津中医药大学学报, 2025, 44(3): 233-240
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(3): 233-240
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.03.07
-
文章历史
收稿日期: 2024-10-30
2. 河北省沧州中西医结合医院放疗一科, 沧州 061000;
3. 河北省沧州中西医结合医院, 沧州 061000;
4. 河北医科大学研究生院, 石家庄 050011
2. Department 1 of Radiotherapy, Cangzhou Hospital of Integrated Traditional and Western Medicine, Cangzhou 061000, China;
3. Hebei Cangzhou Hospital of Integrated Traditional and Western Medicine, Cangzhou 061000, China;
4. Graduate School of Hebei Medical University, Shijiazhuang 050011, China
放射治疗是治疗癌症的重要手段之一,在有效提升患者的生存率的同时,也存在毒副反应。放射性肠炎是腹腔和盆腔放疗常见的毒副反应之一。其临床症状包括腹泻、里急后重,甚至便血[1],这些症状严重影响患者的生活质量,部分患者因此不得不中断治疗,降低了放射治疗的效果。目前,放射性肠炎(RE)的治疗主要包括使用益生菌、镇痛药、抗炎药和抗生素[2-3]。尽管这些治疗方法能缓解症状,但远期效果有限。安肠组方由经方白头翁汤和四君子汤化裁而成,在临床实践中,可以显著改善放射性肠炎患者的临床症状,并减少复发率[4]。但安肠组方对放射性肠炎的治疗作用机制尚不明确,因此,研究建立放射性肠炎小鼠模型,采用安肠组方进行干预,探讨安肠组方的修复作用及可能机制,以期为放射性肠炎的中医药治疗提供实验依据。
1 材料 1.1 药物及主要试剂安肠组方由白头翁汤和四君子汤加减组合而成,药材包括生地榆30 g,白头翁15 g,黄连5 g,白术15 g,茯苓15 g,仙鹤草30 g,木香9 g,炒白芍12 g,甘草6 g。所有中药饮片均由河北省沧州中西医结合医院中药房提供。参照文献[5]分别配制成含生药2.1、4.2、8.4 g/mL的安肠组方药液。马松(Masson)三色染色试剂盒为Solarbio公司产品(批号G1340);肿瘤坏死因子-α(TNF-α,批号JL10484)、白细胞介素-1β(批号JL13044)、白细胞介素-6(IL-6,批号JL18212)和白细胞介素-10(IL-10,批号JL20242)的酶联免疫吸附实验(ELISA)试剂盒均购自上海江莱生物科技有限公司;肿瘤坏死因子-α(TNF-α,批号60291-1-Ig)、白细胞介素-6(IL-6,批号66146-1-Ig)和白细胞介素-10(IL-10,批号60269-1-Ig)的免疫组化抗体均购自武汉proteintech公司;白细胞介素-1β(IL-1β,批号ab315084)免疫组化抗体购自英国abcom公司;ZO-1(批号66452-1-Ig)、claudin-1(批号13050-1-AP)Western- blot抗体均购自武汉proteintech公司;BCA试剂盒为碧云天生物技术有限公司产品。
1.2 动物选取6~8周龄雄性C57BL/6小鼠,购自河南斯克贝斯生物科技股份有限公司,许可证号:SCXK(豫)2020-0005,经河北省沧州中西医结合医院伦理委员会批准同意,批准号:2020018;饲养于中国医学科学院放射医学研究所无特定病原体(SPF)动物设施。小鼠在标准条件下饲养,环境温度(22±2)℃,相对空气湿度40%~70%,光照/暗循环12 h/12 h,连续给予鼠粮和无菌水,以适应环境。将10只小鼠随机分在1个笼子,适应性喂养1周后,用于后续造模和给药。
2 方法 2.1 小鼠RE模型的建立及给药小鼠被随机分为5个实验组,每组包含10只小鼠。实验组分别包括:正常组、模型组、及安肠组方低(2.1 g/mL)、中(4.2 g/mL)、高(8.4 g/mL)剂量的治疗组。除正常组外,其余各组小鼠均接受X射线照射,以建立放射性肠炎(RE)模型。每只小鼠通过腹腔注射0.1 mL 2%异戊巴比妥钠进行麻醉,并在手术板上以仰卧位固定,使用医用直线加速器发射的6MVX射线对小鼠进行全腹部照射,照射范围从剑突延伸到耻骨联合,照射面积为3.0 cm×3.0 cm,非照射区域用铅板屏蔽,照射距离设定为100 cm,剂量率为6 Gy/min,照射持续时间为2.5 min,总照射剂量为15 Gy[6],所有照射实验均在中国医学科学院放射医学研究所完成。在照射后,除正常组和模型组外,其他各组小鼠连续灌胃给药7 d,正常组和模型组小鼠灌胃水,治疗结束后,从各组小鼠中采集血液、粪便和结肠组织样本,以进行后续的指标测定,实验流程图如图 1所示。

|
| 图 1 实验设计流程图 |
记录小鼠的每日体质量变化和生存数量。观察其粪便的形态和颜色,是否出现腹泻或便血情况,这些数据将用于后续的小鼠疾病活动指数(DAI)评分。DAI评分标准见表 1。
通过吸入过量异氟醚进行安乐死后,解剖取出结肠,立即固定在4%多聚甲醛溶液中,并在25 ℃条件下过夜处理。随后,将结肠组织按照常规方法进行脱水、包埋和切片,切片厚度为5 μm。然后进行HE染色,染色后的切片在光学显微镜下进行观察和评估。根据炎症细胞浸润、结肠黏膜损伤及内部结构损伤的程度,比较各组结肠病变的严重程度。
2.4 小鼠结肠组织Masson染色结肠组织处理及切片同HE染色步骤,随后将切片进行Masson染色,用光学显微镜观察结肠组织胶原纤维的数量,并使用ImageJ软件对其进行分析。
2.5 ELISA使用异氟醚麻醉小鼠后,通过眼球取血,将血液收集到干净的EP管中。血液样本在室温(约25 ℃)静置30~60 min以自然凝固。以3 000 r/min离心10~15 min(离心半径为15 cm),分离血清,将上清液(血清)吸出,转移到干净的无菌EP管中。按照说明书操作,通过ELISA检测血清中的IL-1β、IL-6、IL-10和TNF-α含量,并计算结果,结果用各炎症因子的浓度表示。
2.6 免疫组织化学将结肠组织包埋、切片,在含EDTA的高压锅中处理150 s进行抗原修复,然后进行灭活和封闭,一抗IL-1β(1∶500)、IL-6(1∶500)、IL-10(1∶50)和TNF-α(1∶200)在37 ℃下孵育60 min,二抗HRP(1∶2 000)在室温下孵育25 min。随后,使用DAB显色剂进行显色,苏木精反染色,接着进行脱水和封片,最后,用光学显微镜进行观察,并使用ImageJ软件对图像进行分析。
2.7 蛋白免疫印迹(Western blot)分析使用RIPA裂解液提取组织总蛋白,并通过BCA法测定其浓度。等量的总蛋白样品在10%的SDS-PAGE凝胶上进行电泳分离,随后转膜并封闭。膜与目标蛋白的一抗在4 ℃下孵育过夜,所用一抗包括:ZO-1(1∶1 000)、claudin-1(1∶1 000)和GAPDH(1∶5 000)。然后,加入HRP标记的二抗(1∶2 000)在25 ℃下孵育1 h。显影后,使用ImageJ图像分析软件对目标条带的灰度值进行分析。
2.8 统计学方法数据分析是通过使用GraphPad Prism9.5软件(San Diego,CA,USA)来执行的。所有定量数据均以均值±标准差(x ± s)表示。为了检测组间的显著性差异,符合正态分布的采用单因素方差分析(ANOVA),不符合正态分布采用Kruskal-Wallis检验,并在事后分析中使用Tukey多重比较检验来评估各组间的差异。在统计分析中,P<0.05被认为具有统计学意义。
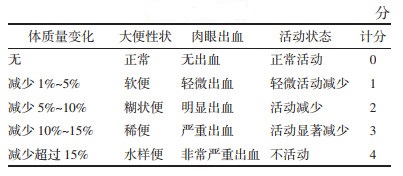
3 结果 3.1 对RE小鼠一般情况的影响造模当天,所有组小鼠体质量没有明显差异。造模后第2天,模型组小鼠体质量出现下降(P<0.01),并出现了黏液血便;与模型组相比,安肠组方治疗组小鼠体质量下降明显缓慢,其中高剂量组小鼠最为明显(P<0.05),见图 2a。从RE小鼠生存情况观察,与正常组相比,模型组小鼠存活率降低;与模型组相比,低、中、高剂量的安肠组方治疗组小鼠存活率则升高,见图 2b。疾病活动指数(DAI)包括体质量变化、腹泻、便血和活动状态的评分[7]。如图 2c所示在造模当天,各组小鼠一般状况良好。模型建立后第1天,模型组小鼠开始出现稀水样便和血便。从第2~6天,DAI评分增加,而到第7天则无明显变化。与正常组相比,模型组小鼠DAI评分增加(P<0.01);与模型组相比,安肠组方治疗组小鼠DAI评分降低,其中高剂量组小鼠最显著(P<0.01)。各组小鼠结肠长度对比发现,与正常组相比,模型组小鼠结肠长度缩短(P<0.01);与模型组相比,安肠组方治疗组小鼠结肠长度增加,其中高剂量组小鼠结肠长度增长(P<0.01),见图 2d。
|
| 注:Control为正常组;Model为模型组;F+ACZFL为放疗+安肠组方低剂量组;F+ACZFM为放疗+安肠组方中剂量组;F+ACZFH为放疗+安肠组方高剂量组。与Control组比较,**P<0.01;与Model组比较,##P<0.01。 图 2 安肠组方对RE小鼠体质量、存活率、疾病活动指数和结肠长度的影响(x ± s,n=10) |
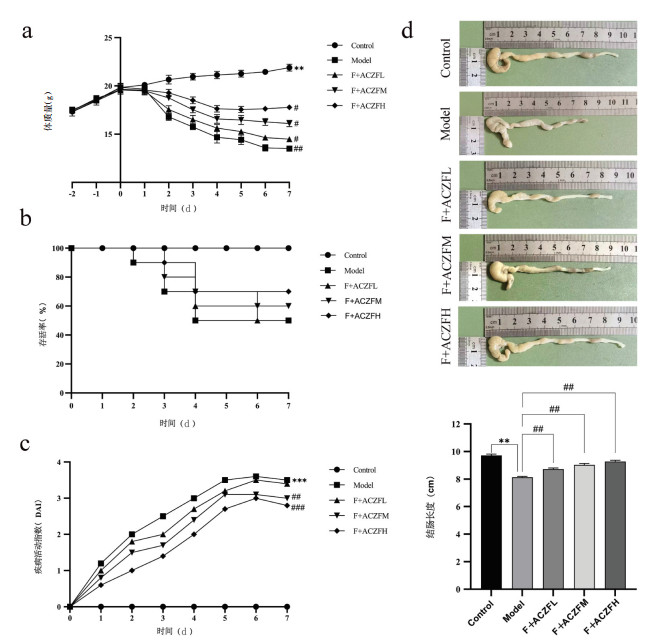
HE染色中,正常组小鼠结肠黏膜完整且基层结构正常,没有明显的炎症细胞浸润。与正常组相比,模型组小鼠结肠组织结构紊乱,隐窝结构消失,黏膜变薄,肠绒毛出现空泡并伴随脱落,并且伴有炎性细胞的浸润;与模型组相比,安肠组方治疗组小鼠结肠组织结构和黏膜损伤均得到了显著的改善,肠绒毛空泡以及脱落减少,炎性细胞浸润的情况也有所减轻,见图 3黑色箭头指向。Masson染色中,正常组小鼠结肠平滑肌区域胶原纤维化较少,正常肌纤维较多,因此整体呈现红色。与正常组相比,模型组小鼠结肠平滑肌区域呈现出明显的蓝色;与模型组相比,安肠组方治疗组小鼠结肠组织中的纤维化面积明显降低,蓝色显著减少,见图 3黑色箭头指向。
|
| 注:Control为正常组;Model为模型组;F+ACZFL为放疗+安肠组方低剂量组;F+ACZFM为放疗+安肠组方中剂量组;F+ACZFH为放疗+安肠组方高剂量组。与Control组比较,**P<0.01;与Model组比较,##P<0.01。 图 3 安肠组方对RE小鼠结肠病理的影响(x ± s,n=10) |
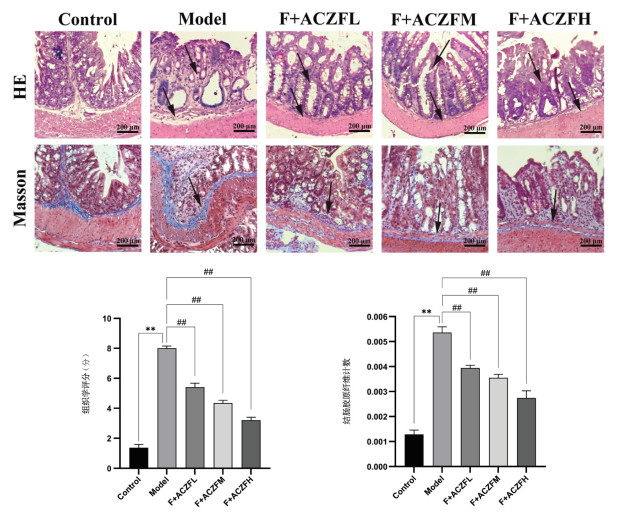
ELISA检测血清结果显示:与正常组相比,模型组小鼠促炎因子TNF-α、IL-1β、IL-6含量增加(分别为P<0.01,P<0.05,P<0.01),抗炎因子IL-10水平降低(P<0.01);与模型组相比,安肠组方低、中、高剂量组小鼠促炎因子TNF-α、IL-1β、IL-6的含量降低(P<0.01,P<0.05),抗炎因子IL-10的水平增加(P<0.01,P<0.05),见图 4a。在免疫组化实验中,阳性信号主要集中在肠黏膜上皮细胞和肠壁上,呈现棕黄色或褐色染色。免疫组化检查结肠组织结果显示,与正常组相比,模型组小鼠TNF-α、IL-1β、IL-6在结肠组织中的表达增加(P<0.01),IL-10表达降低(P<0.01),见图 4b黑色箭头指向;与模型组相比,安肠组方低、中、高剂量组小鼠TNF-α、IL-1β、IL-6的表达降低(P<0.01,P<0.05),IL-10的表达增加(P<0.01),见图 4b黑色箭头指向。
|
| 注:Control为正常组;Model为模型组;F+ACZFL为放疗+安肠组方低剂量组;F+ACZFM为放疗+安肠组方中剂量组;F+ACZFH为放疗+安肠组方高剂量组。与Control组比较,*P<0.05,**P<0.01;与Model组比较,#P<0.05,##P<0.01。 图 4 安肠组方对RE小鼠炎症因子表达的影响(x ± s,n=10) |
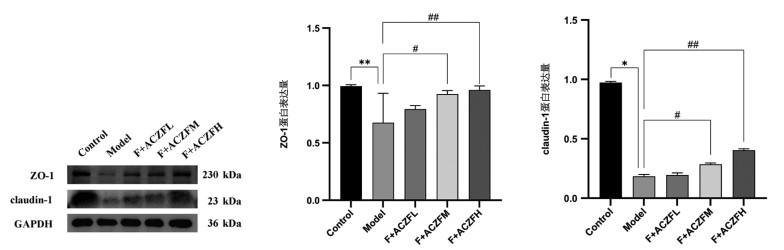
Western blot结果显示:与正常组相比,模型组中ZO-1和claudin-1的蛋白表达量降低(分别为P<0.01和P<0.05);与模型组相比,安肠组方治疗组中ZO-1和claudin-1的蛋白表达升高,其中高剂量组ZO-1和claudin-1蛋白表达升高(P<0.01),见图 5。
|
| 注:Control为正常组;Model为模型组;F+ACZFL为放疗+安肠组方低剂量组;F+ACZFM为放疗+安肠组方中剂量组;F+ACZFH为放疗+安肠组方高剂量组。与Control组比较,*P<0.05,**P<0.01;与Model组比较,#P<0.05,##P<0.01。 图 5 安肠组方对RE小鼠ZO-1、claudin-1蛋白的表达(x ± s,n=10) |
RE是一种多因素驱动的慢性肠道疾病,通常呈现为复发性和持续性的特征[8]。至今,医学界尚未对RE的病因和发病机制达成明确的共识[9-10]。在西医治疗中,主要采用手术、营养支持以及对症治疗疗效并不明显[11]。在中医中,放射线被视为“火热毒邪”,导致放射性肠炎的主要机制是热毒积聚和肠道损伤。由于癌毒的影响,人体的气血阴阳被耗尽,脏腑功能失调,导致气血运行受阻,痰湿和瘀血积聚。治疗应侧重于清热解毒、健脾益气,以调和脏腑功能,恢复正常的气血流通[12]。安肠组方是一种自拟的中药处方,由白头翁汤和四君子汤加减而成,已被证明对小鼠放射性结肠炎具有保护作用。前期研究结果表明其机制与降低肠组织ROS水平,抑制NF-κB表达以减轻炎症;同时下调促凋亡基因Bax蛋白表达、上调抑凋亡Bcl-2蛋白表达;从而抑制细胞凋亡、维持细胞间紧密性和稳定肠黏膜屏障有关[13]。
研究结果显示,X线照射后第4天安肠组方高剂量组小鼠体质量明显高于模型组(P<0.01);X线照射后第5天安肠组方高剂量组小鼠DAI评分显著低于模型组(P<0.01),可见,安肠组方能有效改善放射性肠炎小鼠的相关症状。
在疾病的发展过程中,免疫细胞受到刺激后会释放大量促炎细胞因子,这些细胞因子进一步激发免疫反应,诱导上皮细胞凋亡,损害肠上皮细胞的紧密连接,破坏肠道屏障[14]。其中,IL-1β、IL-6和TNF-α等促炎因子的过度表达是导致RE发生的主要原因[15-16];而IL-10则是一种抗炎因子,在多种免疫反应中发挥反馈调节作用[17]。研究中,模型组小鼠血清和结肠组织中IL-1β、IL-6和TNF-α的促炎因子水平升高,抗炎因子IL-10水平降低,经不同剂量的安肠组方干预后,促炎因子IL-1β、IL-6和TNF-α水平降低,抗炎因子IL-10水平升高。表明安肠组方能够抑制RE小鼠的肠道炎症反应。
肠黏膜屏障的完整性很大程度上取决于肠上皮细胞中紧密连接蛋白的表达水平[18],这些紧密连接蛋白位于基底外侧膜的顶端,构成了细胞旁通路,负责调控离子、溶质、细菌和毒素通过上皮单层的过程,并且维持和传递细胞极性[19]。紧密连接蛋白是紧密连接的重要组成部分,对维持肠黏膜的屏障功能至关重要。目前已经发现了近40种与紧密连接相关的蛋白质,其中ZO-1和claudin-1是两种较为常见且重要的紧密连接蛋白[20]。研究采用X线照射方式建立RE小鼠模型,结果显示,模型组小鼠紧密连接蛋白ZO-1和claudin-1蛋白表达水平降低,经不同剂量安肠组方干预后紧密连接蛋白ZO-1和claudin-1蛋白表达水平升高,表明安肠组方可降低肠黏膜通透性,改善RE小鼠肠道上皮细胞黏膜屏障功能。
综上所述,与前期研究[13]安肠组方能够有效改善大鼠放射性肠炎肠上皮细胞凋亡的结果相比,本研究揭示安肠组方治疗小鼠放射性肠炎的关键机制在于通过抑制促炎细胞因子的高表达来调节炎症反应,降低肠黏膜上皮屏障的通透性,并保持肠上皮细胞的结构完整性,从而有效保护肠道上皮屏障。
| [1] |
STACEY R, GREEN J T. Radiation-induced small bowel disease: Latest developments and clinical guidance[J]. Therapeutic Advances in Chronic Disease, 2014, 5(1): 15-29. DOI:10.1177/2040622313510730 |
| [2] |
MCELVANNA K, WILSON A, IRWIN T. Sucralfate paste Enema: A new method of topical treatment for haemorrhagic radiation proctitis[J]. Colorectal Disease, 2014, 16(4): 281-284. DOI:10.1111/codi.12507 |
| [3] |
SPYROPOULOS B G, MISIAKOS E P, FOTIADIS C, et al. Antioxidant properties of probiotics and their protective effects in the pathogenesis of radiation-induced enteritis and colitis[J]. Digestive Diseases and Sciences, 2011, 56(2): 285-294. DOI:10.1007/s10620-010-1307-1 |
| [4] |
何新颖, 孙云川, 袁香坤, 等. 安肠方保留灌肠治疗急性放射性肠炎的临床疗效观察[J]. 中国中西医结合消化杂志, 2015, 23(1): 31-32, 35. |
| [5] |
魏刚. 标准汤剂论[J]. 中国中医药信息杂志, 1998, 5(4): 6-8. |
| [6] |
戴海明, 杨沙沙. C57BL/6小鼠急性放射性肠炎模型的建立[J]. 安徽理工大学学报(自然科学版), 2023, 43(1): 101-108. |
| [7] |
COOPER H S, MURTHY S N, SHAH R S, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Laboratory Investigation; a Journal of Technical Methods and Pathology, 1993, 69(2): 238-249. |
| [8] |
ⅡZUKA M, ETOU T, SHIMODAIRA Y, et al. Cytapheresis re-induces high-rate steroid-free remission in patients with steroid-dependent and steroid-refractory ulcerative colitis[J]. World Journal of Gastroenterology, 2021, 27(12): 1194-1212. DOI:10.3748/wjg.v27.i12.1194 |
| [9] |
LI D T, FENG Y, TIAN M L, et al. Gut microbiota-derived inosine from dietary barley leaf supplementation attenuates colitis through PPARγ signaling activation[J]. Microbiome, 2021, 9(1): 83. DOI:10.1186/s40168-021-01028-7 |
| [10] |
SHANG L J, YU H T, LIU H B, et al. Recombinant antimicrobial peptide microcin J25 alleviates DSS-induced colitis via regulating intestinal barrier function and modifying gut microbiota[J]. Biomedicine & Pharmacotherapy, 2021, 139: 111127. |
| [11] |
LE BERRE C, RODA G, NEDELJKOVIC PROTIC M, et al. Modern use of 5-aminosalicylic acid compounds for ulcerative colitis[J]. Expert Opinion on Biological Therapy, 2020, 20(4): 363-378. DOI:10.1080/14712598.2019.1666101 |
| [12] |
陈颖, 蒋益兰, 杨晓. 蒋益兰治疗放射性肠炎经验[J]. 湖南中医杂志, 2018, 34(2): 20-21. |
| [13] |
孙云川, 何新颖, 胡秀茹, 等. 安肠组方对急性放射性肠炎模型大鼠肠黏膜的保护作用及机制研究[J]. 河北中医, 2020, 42(4): 586-590, 617, 641. |
| [14] |
刘雅清, 徐航宇, 王敦方, 等. 黄芩汤对溃疡性结肠炎小鼠肠道菌群的影响及肠黏膜屏障的保护作用机制[J]. 中国实验方剂学杂志, 2023, 29(7): 11-19. |
| [15] |
ABBASOLU S D, ERBIL Y, EREN T, et al. The effect of heme oxygenase-1 induction by octreotide on radiation enteritis[J]. Peptides, 2006, 27(6): 1570-1576. |
| [16] |
GUO J M, LIU Z, ZHANG D F, et al. TLR4 agonist monophosphoryl lipid A alleviated radiation-induced intestinal injury[J]. Journal of Immunology Research, 2019, 2019: 2121095. |
| [17] |
MAO X C, YANG C C, YANG Y F, et al. Peripheral cytokine levels as novel predictors of survival in cancer patients treated with immune checkpoint inhibitors: A systematic review and meta-analysis[J]. Frontiers in Immunology, 2022, 13: 884592. |
| [18] |
HE K Y, LEI X Y, WU D H, et al. Akkermansia muciniphila protects the intestine from irradiation-induced injury by secretion of propionic acid[J]. Gut Microbes, 2023, 15(2): 2293312. |
| [19] |
PÉREZ-REYTOR D, PUEBLA C, KARAHANIAN E, et al. Use of short-chain fatty acids for the recovery of the intestinal epithelial barrier affected by bacterial toxins[J]. Frontiers in Physiology, 2021, 12: 650313. |
| [20] |
尚威, 吴华, 陈艳, 等. 蒙花苷对溃疡性结肠炎小鼠肠黏膜屏障的影响[J]. 免疫学杂志, 2022, 38(5): 424-431. |
 2025, Vol. 44
2025, Vol. 44