文章信息
- 张金凤, 周聪
- ZHANG Jinfeng, ZHOU Cong
- 参芪降糖胶囊通过调节NF-κB/NLRP3通路对糖尿病动脉粥样硬化大鼠糖脂代谢、内皮细胞功能的影响
- Impacts of Shenqi Jiangtang Capsules on glucose and lipid metabolism and endothelial cell function in diabetes atherosclerotic rats by regulating the NF-κB/NLRP3 pathway
- 天津中医药大学学报, 2025, 44(3): 241-248
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(3): 241-248
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.03.08
-
文章历史
收稿日期: 2025-01-08
糖尿病(DM)患者多伴有血脂异常,易出现心血管、肾、神经等多方面并发症,动脉粥样硬化(AS)是以脂质积聚、内膜增厚、内皮细胞紊乱和斑块形成为特征的一种慢性炎症疾病,是导致DM患者生活障碍以及死亡的主要原因[1-2]。近年来,利用中医药调节血脂、改善血管内皮细胞功能、减少泡沫细胞生成、降低炎症、促进肠道微生物代谢平衡已略见成效[3]。参芪降糖胶囊(简称SJC)是一种中药制剂,主要由人参茎叶总皂苷、五味子、黄芪等11味中药组成,临床上主要用于治疗2型糖尿病及其并发症,可有效改善患者胰岛功能、降低血糖水平[4-5]。据报道,SJC对DM合并脂代谢异常患者的糖、脂代谢均有一定的调节作用,还能改善胰岛素抵抗,调节炎症因子水平[6]。然而,SJC对DM合并AS的影响与机制尚未可知。研究发现,核因子(NF)-κB/NOD样受体蛋白3(NLRP3)信号通路作为重要炎症信号通路与糖尿病AS发病密切相关,通过抑制该通路能够减轻AS小鼠炎症反应及细胞焦亡,减轻主动脉病理学损伤[7]。因此,研究将探究SJC对糖尿病AS大鼠糖脂代谢、内皮细胞功能的影响及相关NF-κB/NLRP3通路的调控作用,以期为DM合并AS的治疗提供参考。
1 材料与方法 1.1 动物4周龄SD雄性大鼠(SPF级),购自上海市公共卫生临床中心[SCXK(沪)-2020-0002]。实验环境设置为12 h/12 h光暗循环,温度(25±1)℃,湿度50%±5%,动物被允许自由摄食、饮水。实验操作遵守实验室相关规定。该研究得到本院动物伦理委员会的批准(批号:23-15906)。
1.2 试剂与仪器SJC(每粒0.35 g,河南羚锐制药股份有限公司);链脲佐菌素(STZ,ABT650),购自金克隆生物公司;NLRP3激活剂(AAM149645),购自上海迈瑞尔生化科技有限公司;高脂饲料(XT108C),购自协同生物;白介素(IL)-1β(MM-0922R2)、IL-6(MM-0190R2)、肿瘤坏死因子(TNF)-α(MM-0180R2)酶联免疫吸附测定法(ELISA)试剂盒,购自酶免生物;苏木精-伊红(HE)染色试剂盒(C0105S),购自碧云天生物;一抗磷酸化(p)-NF-κB p65(ab239882)、NF-κB p65(ab288751)、NLRP3(ab263899)、凋亡相关斑点样蛋白(ASC,ab307560),购自美国Abcam公司;活化的半胱天冬酶-1(Cleaved-Caspase-1,4199),购自美国CST公司。
血糖仪,购自强生集团;显微镜,购自日本Keyence公司;Tanon 1600凝胶成像分析仪,购自天能集团。
1.3 方法 1.3.1 造模和分组动物适应1周并随机分成空白组、模型组、SJC低剂量组、SJC高剂量组和SJC高剂量+NLRP3激活剂组,依据既往相关研究结果,预实验中造模成功率以及后续指标的检测及重复次数等,每组包含18只大鼠。除空白组外,所有大鼠采用一次性腹腔注射STZ联合高糖高脂饲养构建糖尿病AS模型[8]:高脂饲料饲养8周,随后禁食不禁饮12 h,单次腹腔注射STZ 45 mg/kg,未造模大鼠使用普通饲料喂养并单次腹腔注射等体积柠檬酸缓冲液。STZ注射1周后,连续两次尾尖取血,测得空腹6 h后血糖,空腹血糖(FBG)≥11.1 mmol/L,且胆固醇和三酰甘油(TG)显著升高,随机取3只大鼠处死,取其主动脉组织观察其病理变化,发现大鼠管腔内膜不规则增厚并形成斑块,炎症细胞浸润可表示糖尿病AS模型构建成功[8],大鼠造模成功率为62%,建模过程中损失大鼠及时补充。建模完成后,SJC低、高剂量组大鼠灌胃每天284、568 mg/kg SJC(按人与大鼠的体表面积换算大鼠给药剂量,每天284 mg/kg为人临床等效剂量);SJC高剂量+NLRP3激活剂组大鼠在灌胃每天568 mg/kg SJC前1 h给予300 mg/kg NLRP3激活剂灌胃(每2天1次)[9];空白组和模型组大鼠灌胃等量生理盐水。给药持续8周。
1.3.2 大鼠一般情况观察并记录给药期间各组大鼠的毛色、行为活动、精神状态等一般情况。
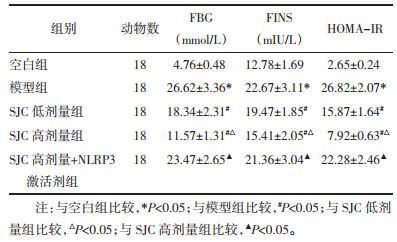
1.3.3 生化指标检测给药期结束第2天,采用1.5%戊巴比妥钠麻醉大鼠,断头采血,立即使用血糖仪检测FBG。血液样本静置30 min,离心15 min(离心半径10 cm),3 000 r/min取上层血清。取少部分血清,根据ELISA试剂盒相应操作要求分别检测FINS、IL-1β、IL-6、TNF-α水平,计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FINS×FBG/22.5。剩余血清分装储存,待测。
1.3.4 血清血脂水平检测取1.3.3血清样本,使用自动分析仪检测总胆固醇(TC)、TG、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)的含量。
1.3.5 主动脉病理学观察采集每组中6只大鼠的胸主动脉,固定24 h后进行乙醇梯度脱水,然后使用石蜡包埋,切片,进行HE染色,光镜下观察病理学特征。
1.3.6 主动脉内皮功能测定每组中选择6只动物采集胸主动脉,浸泡于预冷的氧饱和的Krebs液,取出主动脉脂肪,并修剪为2~3 mm血管环;然后将血管环悬挂在张力换能器上,通入95%O2和5%CO2混合气体,给予血管1.5~2.0 g的前负荷,使用生物信号采集分析器记录血管张力变化。
1.3.7 p-NF-κB p65、NF-κB p65、NLRP3蛋白表达检测取每组剩余6只大鼠胸主动脉内膜,匀浆,提取样品蛋白,并检测其浓度。然后将蛋白样品进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,转膜,封闭聚偏(二)氟乙烯(PVDF)膜,剪切目的条带分别置于p-NF-κB p65、NF-κB p65、NLRP3(1∶1 000)中过夜,加入二抗(1∶2 000)孵育2 h后加入ECL化学发光剂显影,Tanon 1600软件拍照并评估蛋白表达水平。
1.3.8 Cleaved-Caspase-1、ASC蛋白表达检测取1.3.5石蜡切片,免疫组化法检测蛋白表达。切片脱蜡、抗原修复后,加入一抗Cleaved-Caspase-1、ASC抗体(1∶100)孵育过夜后,再加入二抗孵育30 min,最后使用二氨基联苯胺(DAB)显色、封片,显微镜下观察并拍照。
1.4 统计学方法数据使用GraphPad Prism 8.0.2分析,经Shapiro-Wilk正态分布检验以及方差齐性检验后符合正态分布的计量资料以均数±标准差(x±s)表示,组间差异采用单因素方差分析比较,进一步两两比较采用SNK-q检验。P < 0.05认为有统计学意义。
2 结果 2.1 各组大鼠一般情况比较空白组大鼠毛色、饮食、二便无异常,精神状态及活动状况良好;模型组大鼠体型瘦弱,毛发干枯,多食多饮多尿,精神恍惚,活动极少;相较于模型组,SJC低、高剂量组大鼠毛色光泽增加,精神状态和多饮多尿状况好转;相较于SJC高剂量组,SJC高剂量+NLRP3激活剂组大鼠活动减少,毛发脱落无光泽,体型瘦弱,二便增加。
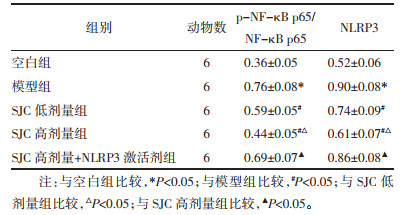
2.2 各组大鼠血清FBG、FINS和HOMA-IR水平比较与空白组比较,模型组大鼠血清FBG、FINS、HOMA-IR水平均升高(P < 0.05);与模型组比较,SJC低、高剂量组大鼠血清上述指标水平呈剂量依赖性降低(P < 0.05);NLRP3激活剂减弱了SJC高剂量对血清FBG、FINS、HOMA-IR水平的抑制(P < 0.05)。见表 1。
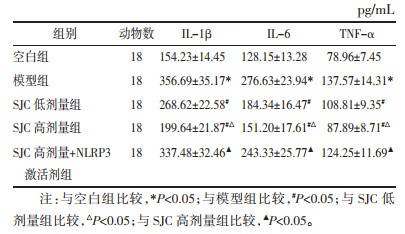
与空白组比较,模型组大鼠血清IL-1β、IL-6、TNF-α炎症因子水平均升高(P < 0.05);与模型组比较,SJC低、高剂量组大鼠炎症因子水平剂量依赖性降低(P < 0.05);NLRP3激活剂减弱了SJC高剂量对大鼠血清炎症因子水平的抑制作用(P < 0.05)。见表 2。
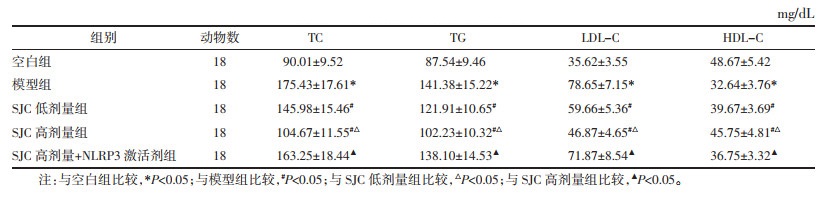
与空白组比较,模型组大鼠血清血脂水平(TC、TG、LDL-C)含量升高,HDL-C含量降低(P < 0.05);SJC低、高剂量组大鼠血清血脂水平变化与模型组大鼠水平相反(P < 0.05);NLRP3激活剂减弱了SJC高剂量对大鼠血脂变化的抑制作用(P < 0.05)。见表 3。
空白组大鼠主动脉组织管腔内皮光滑、无增生,无钙化、泡沫细胞,平滑肌细胞排列整齐;模型组大鼠管腔内膜不规则增厚并形成斑块,炎症细胞浸润,可见钙化、泡沫细胞,平滑肌排列不规则;相较于模型组,SJC低、高剂量组大鼠血管内斑块减少,中膜钙化少见,炎性细胞浸润减少,整体病变程度减轻;相较于SJC高剂量组,SJC高剂量+NLRP3激活剂组大鼠仍有大量泡沫细胞,内膜增厚、大量斑块凸起,细胞排列不规则。见图 1。
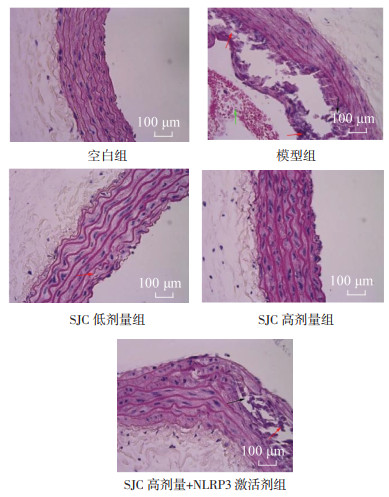
|
| 注:红色剪头表示炎症细胞浸润,绿色剪头代表泡沫细胞,黑色箭头代表钙化。 图 1 HE染色检测各组大鼠主动脉病理学(×400) |
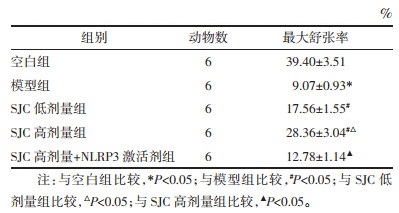
与空白组比较,模型组大鼠最大舒张率降低(P < 0.05);与模型组比较,SJC低、高剂量组大鼠最大舒张率剂量依赖性升高(P < 0.05);与SJC高剂量组比较,SJC高剂量+NLRP3激活剂组大鼠最大舒张率降低(P < 0.05)。见表 4。
与空白组比较,模型组大鼠p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平升高(P < 0.05);与模型组比较,SJC低、高剂量组大鼠p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平剂量依赖性降低(P < 0.05);与SJC高剂量组比较,SJC高剂量+NLRP3激活剂组大鼠p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平升高(P < 0. 05)。见图 2和表 5。
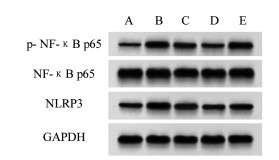
|
| 注:A:空白组;B:模型组;C:SJC低剂量组;D:SJC高剂量组;E:SJC高剂量+NLRP3激活剂组。 图 2 Western blot检测各组大鼠主动脉内膜p-NF-κB p65、NF-κB p65、NLRP3蛋白的表达 |
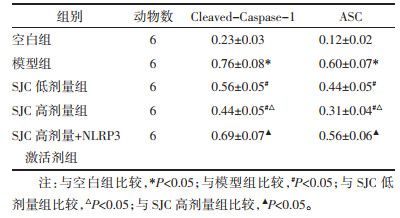
与空白组比较,模型组大鼠Cleaved-Caspase-1、ASC蛋白表达水平升高(P < 0.05);与模型组比较,SJC低、高剂量组大鼠上述蛋白水平剂量依赖性降低(P < 0.05);NLRP3激活剂减弱了SJC高剂量对大鼠上述蛋白表达的抑制作用(P < 0.05)。见图 3和表 6。
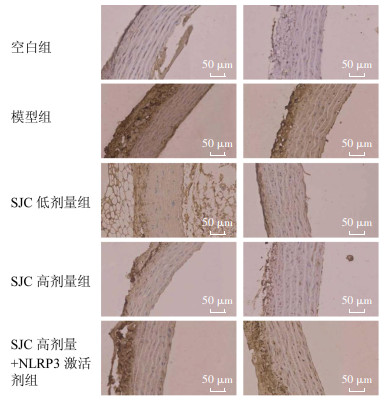
|
| 图 3 免疫组化检测各组大鼠主动脉Cleaved-Caspase-1、ASC蛋白表达(×400) |
大量研究调查显示,DM与微血管和大血管并发症以及一系列非典型合并症会导致患者过高的病死率[10]。AS是一种血管炎症疾病,糖脂代谢异常、慢性炎症反应是AS的发展的关键因素[11]。本研究采用高脂饲料喂养+腹腔注射链脲佐菌素建立糖尿病AS大鼠模型,结果发现,糖尿病AS大鼠体型瘦弱,毛发干枯,多食多饮多尿,精神恍惚,呈现典型的DM特征,主动脉管腔内膜不规则增厚且形成斑块,炎症细胞浸润,可见钙化、泡沫细胞,平滑肌排列不规则,血管内皮依赖性舒张功能降低,提示糖尿病AS模型建立成功,研究大鼠建模成功率约为62%,此项过程有3只大鼠在建立模型过程中发生死亡;中药复方是一个复杂的整体[12],SJC作为一种中药制剂,临床用于治疗气阴两虚的2型糖尿病(T2DM)及其并发症,且具有一定的降糖疗效,但对该制剂在糖尿病AS中的基础实验作用效果及其可能的作用基础尚不十分清楚[13],研究通过使用SJC干预AS大鼠,结果显示低、高剂量的SJC干预都能使AS大鼠毛色光泽增加,精神状态和多饮多尿状况好转,血管内斑块减少,中膜钙化少见,炎性细胞浸润减少,整体病变程度减轻,内皮依赖性舒张功能升高,且高剂量的效果更好,提示SJC尤其是高剂量SJC可以通过抑制炎症反应和提高血管舒张功能来抑制糖尿病AS的进展。
高糖高脂饮食会导致内皮功能障碍,并通过炎症反应和细胞外基质降解导致AS的发生[14]。临床研究表明,给予DM合并AS患者胰岛素治疗可以明显降低血糖水平和血脂水平,改善疾病进展[15]。研究结果发现,SJC可以降低糖尿病AS大鼠血清FBG、FINS、HOMA-IR、血脂水平水平,提示SJC对糖尿病AS大鼠异常的糖脂代谢发挥改善功能。另外,在AS的病理进程中,炎症因子与脂肪条纹、纤维斑块、不稳定斑块、AS斑块的形成和破裂密切相关[16]。众所周知,NF-κB能够调节免疫炎症相关疾病,激活NF-κB通路能够引起促炎因子IL-1β、IL-6、TNF-α水平均升高[17-18]。NLRP3炎症小体能够募集ASC、促进Caspase-1激活转化为Cleaved-Caspase-1,促进内皮细胞焦亡,而血管内皮细胞损伤是AS起始环节及斑块不稳定的关键因素,保护内皮细胞功能可有效延缓AS发展[19-20]。NF-κB信号传导中存在的多个转录活性分子,p65是其中的一员并且与NF-κB共同作用参与够功能调节[21]。据报道,p65在糖尿病AS模型大鼠主动脉中被活化,且白藜芦醇的干预可以通过抑制转录因子NF-κB p65、炎症指标NLRP3和IL-1β、细胞焦亡指标Caspase-1和GSDMD来抑制钙化指标Runx2和BMP2表达,进而抑制AS斑块形成并减轻AS病变[22-23]。本研究中,糖尿病AS大鼠血清炎症因子水平升高,主动脉内膜p-NF-κB p65/NF-κB p65、NLRP3、Cleaved-Caspase-1、ASC蛋白表达升高,与刘超等[24]的研究类似,表明糖尿病AS大鼠NF-κB/NLRP3通路处于活化状态,主动脉内皮细胞焦亡,炎性反应增强;SJC能够降低AS大鼠血清炎症因子IL-1β、IL-6、TNF-α水平,下调主动脉内膜NF-κB/NLRP3通路蛋白表达降低,提示NF-κB/NLRP3通路受到抑制,主动脉内皮细胞焦亡和炎性反应减少,这可能是SJC改善糖尿病AS大鼠主动脉血管病理学损伤的原因。既往研究显示,二乙基二硫代氨基甲酸酯是NLRP3激活剂,其可促进炎症和细胞焦亡,在糖尿病并发症中发挥关键作用[25]。为了验证SJC与NF-κB/NLRP3信号通路的调控关系,实验增加设置了SJC与NLRP3激活剂(二乙基二硫代氨基甲酸酯)共同处理组,结果发现NLRP3激活剂减弱了SJC对糖尿病AS大鼠的保护作用,进一步验证SJC对糖尿病AS大鼠疾病的改善作用与抑制NF-κB/NLRP3通路以降糖降脂、减轻炎症、提高血管舒张功能有关。
然而,目前的研究存在一些局限性。尽管NF-κB/NLRP3信号通路可能与SJC在糖尿病AS中降糖、降脂、抗内皮功能损伤和抗炎作用的原因,但是,SJC对AS发生和发展的其他机制的影响,如氧化应激、自噬、细胞内Ca2+信号、黏附分子和蛋白激酶C应在未来的研究中进行探讨。此外,建议评估细胞焦亡作为NF-κB/NLRP3信号通路的主要末端效应物之一,分析SJC在AS保护作用中的作用。SJC的中药成分复杂,具体哪种成分在糖尿病AS中发挥作用需要继续深入研究。最后,需要进行补充研究,来转化这些有希望的实验结果,以预防或减少与糖尿病AS患者相关的并发症。
综上所述,SJC可能通过抑制NF-κB/NLRP3信号通路改善糖尿病AS大鼠糖脂代谢和内皮细胞功能。研究结果为SJC通过调节新的NF-κB/NLRP3信号通路来调控糖尿病AS的机制提供了新的见解。另外,SIC的成分包括人参茎叶皂苷、麦冬、黄芪、五味子等,人参茎叶皂苷、黄芪活性成分已被证实能够通过降糖、降脂抑制动物模型的糖尿病AS进展[26-27],而其他成分也被证实能够抑制DM并发症进展,如黄连-麦冬药能降低血糖,改善DM肾病大鼠肾功能[28];五味子中的五味子素A可以通过AdipoR1/AMPK-ROS/线粒体损伤,减轻DM肾病中的铁死亡和NLRP3炎症小体介导的细胞焦亡,提示五味子素A可能是DM肾病或其他DM并发症的治疗选择[29];茯苓三萜提取物通过激活PI3K-AKT信号通路,减少炎症反应,促进血管生成,从而治愈DM溃疡[30]。目前,SIC的大部分成分尚未在糖尿病AS中得到研究,虽然研究证实了SIC对糖尿病AS具有改善作用,但具体的作用靶点,也就是发挥作用的具体成分尚未得到证实,需要更进一步的研究。
| [1] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)(上)[J]. 中国实用内科杂志, 2021, 41(8): 668-695. |
| [2] |
POZNYAK A, GRECHKO A V, POGGIO P, et al. The diabetes mellitus-atherosclerosis connection: The role of lipid and glucose metabolism and chronic inflammation[J]. International Journal of Molecular Sciences, 2020, 21(5): 1835. DOI:10.3390/ijms21051835 |
| [3] |
杨双, 王忠良. 中医药治疗动脉粥样硬化作用机制的研究进展[J]. 中医药学报, 2023, 51(3): 107-111. |
| [4] |
何叶, 汪琴芳. 参芪降糖胶囊联合瑞格列奈对2型糖尿病血糖水平及胰岛功能的影响[J]. 中国医学创新, 2023, 20(25): 68-71. DOI:10.3969/j.issn.1674-4985.2023.25.016 |
| [5] |
刘平. 参芪降糖胶囊联合二甲双胍治疗2型糖尿病临床观察[J]. 中西医结合研究, 2023, 15(2): 91-93, 102. DOI:10.3969/j.issn.1674-4616.2023.02.005 |
| [6] |
单洁, 田霖林, 车立群, 等. 参芪降糖胶囊对2型糖尿病合并血脂异常患者糖、脂代谢的影响[J]. 中国实验方剂学杂志, 2015, 21(15): 168-171. |
| [7] |
陈金晖, 陈青青, 梅统, 等. 利拉鲁肽基于NF-κB/NLRP3通路介导的焦亡途径对小鼠动脉粥样硬化的干预作用研究[J]. 浙江医学, 2021, 43(17): 1835-1840, 1936. |
| [8] |
符杰, 邓红艳, 李玉凯, 等. 丹参酮ⅡA抑制糖尿病动脉粥样硬化大鼠动脉平滑肌细胞凋亡及机制[J]. 中南医学科学杂志, 2023, 51(1): 37-40. |
| [9] |
尹玮, 王强, 祝英杰. 冠通方通过干预NLRP3炎症小体信号通路对大鼠血管内膜损伤后再狭窄作用机制分析[J]. 四川中医, 2022, 40(7): 71-76. |
| [10] |
LYSSENKO V, VAAG A. Genetics of diabetes-associated microvascular complications[J]. Diabetologia, 2023, 66(9): 1601-1613. |
| [11] |
JEBARI-BENSLAIMAN S, GALICIA-GARCÍA U, LARREA-SEBAL A, et al. Pathophysiology of atherosclerosis[J]. International Journal of Molecular Sciences, 2022, 23(6): 3346. |
| [12] |
刘传鑫, 孔娇. 体质毒理学: 中药安全性评价的新方向[J]. 世界科学技术-中医药现代化, 2023, 25(12): 3776-3784. |
| [13] |
苑楠楠, 王宏进, 孙琪, 等. 基于UHPLC-Q-ExactiveOrbitrapMS鉴定参芪降糖胶囊在大鼠体内的代谢产物[J]. 中草药, 2023, 54(22): 7358-7373. |
| [14] |
胡钟竞, 王杰. 动脉粥样硬化形成机制及影响因素研究概况[J]. 临床医药文献电子杂志, 2020, 7(50): 197-198. |
| [15] |
梅周, 殷应传, 周晓惠, 等. 胰岛素泵对2型糖尿病合并颈动脉粥样硬化患者糖脂代谢及氧化应激的影响[J]. 中国医刊, 2020, 55(2): 200-202. |
| [16] |
KARUNAKARAN D, NGUYEN M A, GEOFFRION M, et al. RIPK1 expression associates with inflammation in early atherosclerosis in humans and can be therapeutically silenced to reduce NF-κB activation and atherogenesis in mice[J]. Circulation, 2021, 143(2): 163-177. |
| [17] |
POMA P. NF-κB and Disease[J]. International Journal of Molecular Sciences, 2020, 21(23): 9181. |
| [18] |
WANG Y, ZHANG W W, MA N N, et al. Overfeeding with a high-concentrate diet activates the NOD1-NF-κB signalling pathway in the mammary gland of mid-lactating dairy cows[J]. Microbial Pathogenesis, 2019, 128: 390-395. |
| [19] |
TANG Y S, ZHAO Y H, ZHONG Y, et al. Neferine inhibits LPS-ATP-induced endothelial cell pyroptosis via regulation of ROS/NLRP3/Caspase-1 signaling pathway[J]. Inflammation Research, 2019, 68(9): 727-738. |
| [20] |
张艺琳, 郭霖杨, 邱月, 等. microRNA干预内皮细胞凋亡影响动脉粥样硬化的研究进展[J]. 中国老年学杂志, 2023, 43(8): 2002-2006. |
| [21] |
ALHARBI K S, FULORIA N K, FULORIA S, et al. Nuclear factor-kappa B and its role in inflammatory lung disease[J]. Chemico-Biological Interactions, 2021, 345: 109568. |
| [22] |
HAN X, QI H, NIU J. L-limonene reduces aortic artery atherosclerosis by inhibiting oxidative stress/inflammatory responses in diabetic rats fed high-fat diet[J]. Chin J Physiol, 2023, 66(3): 129-136. |
| [23] |
LI S, LI Q, ZHOU Q, et al. Attenuating atherosclerosis through inhibition of the NF-κB/NLRP3/IL-1β pathway-mediated pyroptosis in vascular smooth muscle cells (VSMCs)[J]. Cardiovasc Ther, 2024, 2024: 1506083. |
| [24] |
刘超, 王琳, 姚凤云, 等. 加味温胆汤调控NF-KB/NLRP3通路干预炎性反应抗大鼠糖尿病动脉粥样硬化的机制[J]. 中国实验方剂学杂志, 2024, 30(14): 71-77. |
| [25] |
李彬彬, 李少君, 陈贵尚, 等. 银杏素对糖尿病视网膜病变大鼠视网膜病变及NLRP3/caspase-1/GSDMD焦亡通路的影响[J]. 中国老年学杂志, 2024, 44(20): 5054-5058. |
| [26] |
王银萍, 吴家祥, 王心蕊, 等. 大豆皂甙和人参茎叶皂甙的抗糖尿病动脉粥样硬化作用[J]. 白求恩医科大学学报, 1994, 20(6): 551-554. |
| [27] |
葛凡, 王文恺, 朱景天, 等. 黄芪甲苷通过NLRP3炎性小体调节糖尿病动脉粥样硬化早期大鼠血脂及炎症因子的研究[J]. 南京中医药大学学报, 2021, 37(3): 383-387. |
| [28] |
李少玉, 龚曼, 李秋芳, 等. 基于EGFR/PI3K/Akt信号通路探讨黄连-麦冬药对延缓糖尿病肾病的作用机制[J]. 中国实验方剂学杂志, 2024, 30(20): 22-29. |
| [29] |
WANG X, LI Q, SUI B, et al. Schisandrin A from Schisandra chinensis attenuates ferroptosis and NLRP3 inflammasome-mediated pyroptosis in diabetic nephropathy through mitochondrial damage by AdipoR1 ubiquitination[J]. Oxid Med Cell Longev, 2022, 2022: 5411462. |
| [30] |
DING X, LI S, HUANG H, et al. ) Wolf in the treatment of diabetic ulcers via regulating the PI3K-AKT signaling pathway[J]. J Ethnopharmacol, 2024, 325: 117812. |
 2025, Vol. 44
2025, Vol. 44