文章信息
- 李函舟, 温伟波, 孔祥英, 邢利威, 吕树泉, 边育红, 崔换天
- LI Hanzhou, WEN Weibo, KONG Xiangying, XING Liwei, LYU Shuquan, BIAN Yuhong, CUI Huantian
- 基于“糖毒损肾、积微致著”病机探讨糖尿病肾脏病相关“代谢记忆”形成的中西医机制
- Based on the pathogenesis of "glucotoxicity damaging the kidney, and the accumulation of minor to significant": exploring the mechanisms of "metabolic memory" formation in diabetic kidney disease from both traditional Chinese and Western medical perspectives
- 天津中医药大学学报, 2025, 44(3): 269-277
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(3): 269-277
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.03.12
-
文章历史
收稿日期: 2024-10-16
2. 云南中医药大学第一临床医学院, 昆明 650500;
3. 中国中医科学院中药研究所, 北京 100700;
4. 河北省沧州中西医结合医院内分泌科, 沧州 061001
2. The First Clinical Medical College of Yunnan University of Chinese Medicine, Kunming 650500, China;
3. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
4. Cangzhou Hospital of Integrated Traditional Chinese and Western Medicine in Hebei Province, Cangzhou 061001, China
糖尿病肾脏病(DKD)是糖尿病(DM)微血管并发症之一[1],同时,也是导致终末期肾病(ESRD)的主要原因之一[2]。当前针对DKD的治疗,主要从严格控制血糖和血压,减少蛋白尿排出等方面入手[3]。但是DKD相关的ESRD发生率仍居高不下,严重影响患者的生活质量,并加重社会经济负担。因此,寻找切实可行的治疗手段,以延缓DKD进展迫在眉睫。
近年来,随着多项临床研究的进展,“代谢记忆”现象重新得到许多人的关注[4]。研究发现,DM患者由于早期高血糖的影响,即使后期采取有效措施将血糖控制在正常水平,仍易发生DM相关并发症如DKD等,这一临床现象即被称为“代谢记忆”[5]。“代谢记忆”的提出在作为糖尿病研究中1项重大突破的同时,也为DKD的防治带来了新的挑战。根据DKD临床表现,可归属于“消渴”“消肾”“水肿”“尿浊”等范畴,而DKD相关“代谢记忆”形成于DKD出现之前、DM发生之后,所以应属“消渴”范畴。近些年,知名DM专家岳仁宋教授等人将这些病理产物称之为“糖毒”[6]。同时根据中医对糖毒的认识,对比DKD相关“代谢记忆”发病表现,提示两者之间具有密切相关性。文章从“糖毒”理论出发,结合DKD临床表现,将DKD相关“代谢记忆”形成的病理特征概括为“糖毒损肾、积微致著”病机,以期为“代谢记忆”的诊疗提供更多思路。
1 “代谢记忆”现象——连接代谢水平与DM并发症的桥梁大型随机研究已经证实,早期强化血糖控制可降低DM并发症(包括微血管和大血管并发症)的风险。此外,流行病学和前瞻性数据表明早期强化血糖控制对临床结果具有长期影响。在1983—1993年,1项由1 441名1型糖尿病(T1DM)患者参与的DM控制和并发症试验(DCCT)中发现[5],接受强化治疗(每天至少接受3次胰岛素注射或外部泵连续胰岛素输注)的患者较常规治疗(每天接受1次或2次胰岛素注射)患者在平均随访期6.5年后,DKD、糖尿病视网膜病变(DR)等并发症发生率明显降低。而在DCCT结束后的1994年,糖尿病干预和并发症流行病学(EDIC)启动[4]。EDIC涉及DCCT中的1 394名仍生存参与者,在此期间,强化治疗与常规治疗两组受试者均接受治疗以控制糖化血红蛋白(HbA1c)处于较低水平(两组间HbA1c水平在此期间无显著差异)。在后续的随访中发现两组间DKD、DR等并发症的发生率均升高,强化治疗组的并发症发生率依然低于常规治疗组[7]。与此同时,英国前瞻性糖尿病研究(UKPDS)和Steno-2试验也在2型糖尿病(T2DM)患者群体中得到了类似的结果[8]。这一系列重要的研究告诉我们,在DM发生后,即使通过有效手段控制血糖,但并发症依然会随着时间的推移而产生[9]。后来的学者将这一现象命名为“代谢记忆”,见图 1。
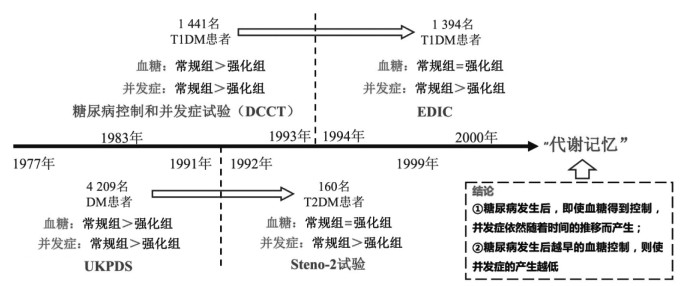
|
| 图 1 “代谢记忆”现象的发现 |
DKD是DM中最常见的并发症之一,其中约有40%的DM患者会逐渐进展为DKD,而ESRD是DKD的主要结局[10]。因此,了解DKD的发病、尽早诊断及时治疗是减少DKD死亡的关键。在DKD的治疗中,尽管通过控制血糖水平能够对疾病的进展产生积极影响,但代谢记忆的存在可能会导致疾病再次恶化。越来越多的研究指出,“代谢记忆”和糖尿病并发症形成的机制包括炎症反应、氧化应激和衰老相关。而表观遗传修饰,如DNA甲基化、组蛋白翻译后修饰等,以及线粒体功能障碍和以上病理过程之间有着错综复杂的关系,不同机制相互之间也存在交叉干扰[11],见图 2。因此,对于“代谢记忆”机制的深入理解以及相关靶点的识别和研究,目前仍处于初步阶段,依旧是未来研究需要深入挖掘的方向。而文章则从研究相对集中的细胞衰老、炎症、氧化应激等3个方面进行归纳探讨。
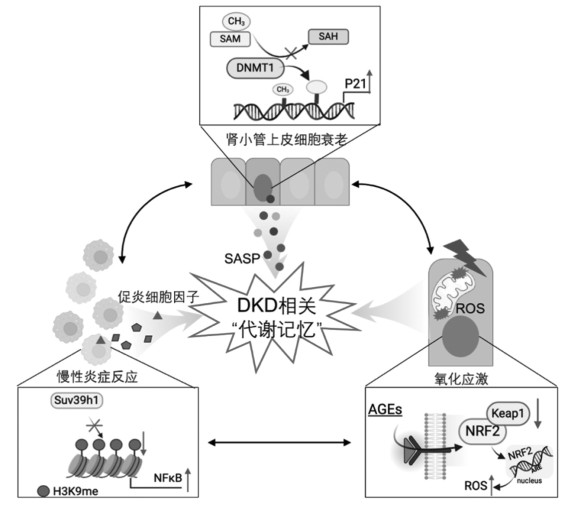
|
| 图 2 DKD“代谢记忆”现象相关机制 |
细胞衰老是一种永久性增殖停滞而非细胞死亡,分为表观遗传诱导的衰老、氧化应激诱导的衰老和DNA损伤诱导的衰老[12]。衰老过程与细胞程序性死亡密切相关[13]。当细胞损伤不能有效修复时,细胞不可逆的功能障碍会导致细胞程序性死亡,包括细胞凋亡、自噬、细胞焦亡和铁死亡[14]。
2.1.1 细胞衰老与DKD“代谢记忆”的关系衰老是指在各种损伤应激及疾病状态下,DNA损伤引发细胞周期停滞等衰老样改变的一种生物学过程[15]。肾小管上皮细胞衰老是导致DKD疾病进展的重要细胞学事件。根据美国著名肾脏病学者Thomson等[16]提出的“肾小管假说”,高糖可引起近端肾小管发生病变,使得肾小管对糖、水、盐的重吸收增强,进而通过管球反馈加剧肾小球负荷,引起DKD早期病理改变,随后肾小管细胞发生衰老,加速疾病向ESRD进展。体内研究发现,对照组与血糖控制组小鼠肾组织中衰老相关因子细胞周期依赖性蛋白激酶抑制因子1A基因(P21)表达较正常小鼠均显著升高,且两组间P21表达无明显差异,初步证实了细胞衰老与DKD相关“代谢记忆”形成的密切关系。进一步实验表明,肾小管上皮细胞中P21表达的升高,促进了DKD相关“代谢记忆”的形成。分别运用单纯高糖培养(HG)与高糖/正常糖(HG/NG)干预肾小管上皮细胞均可诱导P21的上调,且两组之间P21水平无明显差异。对DKD患者肾组织进行免疫组化染色发现,肾小管区域P21表达升高,且P21表达与“代谢记忆”水平(疾病早期血糖控制情况)呈正相关。通过降低P21表达,抑制细胞衰老,可显著减轻DKD相关“代谢记忆”的形成[17]。
2.1.2 调控DKD“代谢记忆”中细胞衰老的相关机制细胞衰老与DKD中的代谢记忆之间的关联主要涉及到表观遗传调控机制。DNA甲基化是指在胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸中,胞嘧啶的第五位碳原子(C5)在DNA甲基转移酶(DNMTs)催化下,共价结合甲基基团形成5-甲基胞嘧啶(5mC),进而通过阻碍转录因子结合或招募甲基结合蛋白(如MeCP2),抑制相关基因表达的表观遗传修饰过程[18]。在DKD“代谢记忆”小鼠模型和肾小管上皮细胞模型中,DNA甲基转移酶1(DNMT1)的表达显著降低[19]。这种降低导致了细胞周期依赖性蛋白激酶抑制因子1A(P21)基因的甲基化水平减少,从而促进了P21基因的表达,引起细胞衰老[20]。P21基因的甲基化可以阻碍其基因转录。在DKD相关“代谢记忆”小鼠肾组织中,P21基因启动子的CpG区域甲基化水平显著降低,这削弱了甲基化对P21基因转录的抑制作用,导致P21表达增加。通过使用DNMT1激动剂,可以提高小鼠肾组织中P21的甲基化水平,降低P21的表达,从而抑制细胞衰老,延缓DKD“代谢记忆”的形成[21]。在另1项研究中发现,STZ诱发白蛋白尿的小鼠组蛋白去乙酰化酶1(SIRT1)表达降低[22]。而有趣的是,SIRT1在近端小管中的特异性过表达通过激活DNA甲基转移酶1(DNMT1)诱导肾小球滤过屏障相关基因的DNA低甲基化,从而减轻蛋白尿。同时该模型伴随足细胞Cldn1基因启动子区的高甲基化,导致紧密连接蛋白(Claudin-1)表达下调,提示近端小管可能通过DNMT1远程调控足细胞基因表达[23]。另一方面,近端小管特异性SIRT1缺失的小鼠白蛋白尿加重,同时Cldn1甲基化降低、组蛋白乙酰化增强和Claudin-1上调。这些研究和其他研究显示了SIRT1对DKD的保护作用,促使进一步评估SIRT1作为DKD治疗靶点的作用[23]。
2.2 炎症反应炎症被定义为先天免疫系统反应的激活,并且被认为是慢性潜在疾病的触发器,而非结果[24]。DKD与全身和局部肾脏炎症有关,其中涉及关键炎症细胞、分子和途径,例如巨噬细胞、核转录因子κB(NF-κB)、Janus激酶/信号转导和转录激活因子(JAK/STAT)途径以及炎症细胞因子[25]。在DKD中,单核吞噬细胞系统被激活。巨噬细胞渗入肾脏,细胞因子释放和单核细胞和巨噬细胞募集的循环最终导致炎症相关的结构变化。肥大细胞等其他细胞也会渗入小管间质并释放炎症介质和蛋白水解酶。巨噬细胞浸润的程度和肥大细胞脱颗粒的程度与估计肾小球滤过率(eGFR)的损失率有关。NF-κB是一种由细胞因子和氧自由基激活的转录因子,可控制参与不同过程(如免疫反应和炎症)的基因表达。此外,NF-κB在不同因素、分子和通路之间的相互作用中起着核心作用,这些相互作用导致DKD中观察到的结构改变和功能异常,例如肾素-血管紧张素系统的激活、晚期糖基化终产物的积累以及烟酰胺腺嘌呤二核苷酸磷酸氢(NADPH)依赖性氧化应激[26]。
2.2.1 炎症反应与DKD“代谢记忆”的关系越来越多的人认为炎症反应是糖尿病微血管并发症进展的核心[27]。高糖环境下,组织中的高血糖可激活多种信号通路,如Janus激酶/信号转导和转录激活子(JAK-STAT)信号通路[28]、NF-E2相关因子2/Kelch样ECH相关蛋白1(Nrf2-keap1)通路[29]等,协调细胞转录,诱导单核细胞浸润、趋化因子产生和分泌,驱动炎症和巨噬细胞浸润,导致组织损伤。而炎症反应中的多种炎性因子和免疫细胞的激活,如巨噬细胞的浸润和炎症细胞因子的分泌,会导致肾脏损伤的持续进展。即使在后期血糖得到控制,这些炎症反应的残留效应可能会形成代谢记忆,使糖尿病患者仍容易发展出与DKD相关的并发症。在代谢记忆现象中,早期高血糖导致的表观遗传修饰,如DNA甲基化、组蛋白修饰和非编码RNA的调节等,会使基因表达和功能发生改变,从而持续激活促炎和促纤维化基因。这些基因的激活会进一步促进炎症反应的持续存在和加剧,形成一个恶性循环,加速DKD的进展。
2.2.2 调控DKD“代谢记忆”中炎症反应的相关机制DKD实际上伴随着一系列促炎途径的激活[30]。纵向临床研究中发现,DKD是唯一一种与残余炎症风险增加一致相关的T2DM并发症,即尽管血脂管理达到了最佳水平,但患者仍然存在高水平的高敏感C反应蛋白(hs-CRP)[31]。单核细胞和巨噬细胞是免疫系统的重要组成部分,参与糖尿病并发症的炎症。肝脏和脂肪组织内巨噬细胞的促炎激活可启动巨噬细胞极化的募集和促进,从而诱导这些细胞分泌炎症细胞因子,包括白介素(IL)-1β、IL-6和肿瘤坏死因子-α(TNF-α)[32]。这反过来又会导致免疫失衡,凸显了巨噬细胞活化在炎症发病机制中的重要作用[33]。而为了进一步研究炎症、免疫和“代谢记忆”之间的复杂关系,Mossel等[34]研究了原代人类巨噬细胞中的代谢迹象。研究结果表明,即使在血糖水平恢复正常后,S100A9和S100A12的表达仍然升高,可能是由于短暂高血糖诱导这些基因启动子区域的组蛋白甲基化。此外,与糖尿病相关的并发症中,先天免疫细胞通过表观遗传调节可以建立非特异性免疫记忆(训练性免疫)。Thiem等[35]利用骨髓细胞移植和单核细胞分离建立了体外和体内训练性免疫模型,他们的研究结果表明,即使在血糖正常化后,葡萄糖调节先天免疫细胞中的组蛋白甲基化水平可能持续存在,从而导致糖酵解增加并在血糖正常化后加剧炎症反应。在DKD患者中,DNA甲基化关键酶DNMT1的水平会随着外周血单核细胞中炎症活动的增加而升高。抑制DNMT1可显著增加外周血单个核细胞中CD4+、CD25+调节性T细胞的比例。另外DNMT1的上调会导致哺乳动物雷帕霉素靶蛋白(mTOR)上游调节因子的异常胞嘧啶甲基化,进而引发炎症反应。这种异常甲基化可能会干扰mTOR信号通路的正常调节,导致免疫细胞的功能失调,从而促进炎症的发生和发展。组蛋白H3赖氨酸9的甲基化(H3K9me3)是1种关键的抑制性且相对稳定的表观遗传染色质标记,在血管内皮细胞中,H3K9me3水平的变化与“代谢记忆”有关[36]。通过过表达组蛋白甲基转移酶3-9同源物1(Suv39h1)抑制因子(通过向H3K9添加甲基基团,促进染色质的抑制状态),可以逆转H3K9me3的持续下调和炎症表型,有助于改善“代谢记忆”现象[37]。另外,研究发现许多启动子区域被招募到高水平H3K9ac组蛋白修饰的基因都参与了NF-κB通路[38]。同时,1项EDIC随访调查研究发现了12个注释的不同甲基化位点,其中包括硫氧还蛋白相互作用蛋白(TXNIP)[39]。而TXNIP已被证明与高血糖和其他相关并发症有关。在体外培养的THP1单体中,高糖可诱导TXNIP持续低甲基化[40]。
2.3 氧化应激氧化应激是指细胞内外产生的一种状态,即氧自由基(ROS)和反应性氮物质(RNS)的生成超过了抗氧化防御系统的清除能力,导致氧化还原失衡[41]。在DKD中,高血糖、高脂血症等因素均可导致氧化应激的加剧,同时氧化应激也是导致“代谢记忆”现象的关键因素之一。
2.3.1 氧化应激与DKD“代谢记忆”的关系在DKD中,长期的高血糖状态会加速ROS的生成,而当ROS的产生超过抗氧化剂的淬灭能力时,就会发生氧化应激[42]。而ROS的积累会导致生物分子的直接氧化,如蛋白质、碳水化合物、脂质和DNA,然后导致信号转导途径的中断和细胞功能障碍,这不仅直接损伤肾脏细胞,还通过产生过量的ROS引发炎症反应,加速肾脏病变的进展[43]。同时,氧化应激还可能影响表观遗传修饰,如DNA甲基化和组蛋白乙酰化,从而在分子水平上“记忆”早期的高血糖状态,即使血糖后期得到控制,仍可能导致并发症的发展。此外,氧化应激还与核因子E2相关因子2(Nrf2)等抗氧化因子相互作用,影响其表达和功能,进而影响肾脏对高糖损伤的修复能力。因此,氧化应激不仅在DKD的发病机制中起着关键作用,也是“代谢记忆”现象的重要驱动因素之一。
2.3.2 调控DKD“代谢记忆”中氧化应激的相关机制线粒体是主要ROS来源,因此线粒体功能障碍与氧化应激密切相关。而氧化应激和线粒体功能障碍在“代谢记忆”发生发展中具有重要的作用[44]。氧化和抗氧化过程中的不平衡会导致氧化应激,进而引发糖尿病并发症中的脂质堆积、炎症和纤维化[45]。ROS作为氧化应激的标志,包含超氧阴离子、羟基、过氧化物自由基以及其他能产生自由基的化合物[46]。Nrf2是1种转录因子,激活抗氧化基因表达[47]。Nrf2可以激活乙二醛酶1(GLO1)基因表达并降低氧化应激;因此,Nrf2激活可能会通过AGEs干预“代谢记忆”[48]。有趣的是,Nrf2会被Kelch样ECH关联蛋白1(KEAP1)识别,随后被泛素化,从而在非应激条件下被蛋白酶体降解。一旦诱发细胞应激,如氧化应激,Kelch样ECH相关蛋白1对Nrf2的识别就会受到抑制,Nrf2就会在细胞质中稳定下来,然后进行核转运[48]。巴多索龙甲基是一种Keap1抑制剂,通过激活Nrf2信号通路发挥抗氧化作用。在DKD患者中,巴多索龙甲基作为抗癌药物使用时被发现具有潜在的肾保护作用[49]。两项2期试验表明,巴多索龙甲基能改善DKD患者的肾小球滤过率(eGFR),但是随后3期BEACON试验因为心血管事件的高发生率而被迫终止。不过鉴于巴多索龙甲基可能逆转DKD中eGFR下降的潜力,日本的TSUBAKI研究还在继续对这种药物在DKD患者中的使用进行更深入的评估[50]。总体而言,有关于氧化应激同DKD相关“代谢记忆”机制的研究仍较少,有待未来进一步研究。
3 DKD“代谢记忆”的中医病机认识——“糖毒损肾、积微致著”“毒”是对机体组织和功能产生损害,致使病情加重甚至难以干预的一类特殊致病因素。一方面,机体产生的代谢废物由于多种原因在体内蓄积,无法排出体外。另一方面,人体正常生长发育所需要的营养物质,由于代谢障碍或摄入超过机体需要,积聚于体内成“毒”。《灵枢·营气》言:“谷入于胃,气传之肺,流溢于中,布散于外。精专者,行于经隧。”在正常情况下,全身的精微物质经由肺的宣发与肃降,均匀分布于血脉及各个脏腑之中,以保障机体的正常生理功能。然而,当脏腑功能出现亏虚损伤或摄入超过机体所需时,精微物质的生成与分布过程便会发生紊乱,导致大量精微物质堆积,无法有效输布至所需部位,进而转化为有害物质,即所谓“糖毒”。糖毒这一概念,融合了湿、痰、热、瘀等多种病理因素,而从现代医学的角度来看,体内过量的葡萄糖、三酰甘油、胆固醇、酮体等代谢产物均可归入其范畴。
而“糖毒”伏藏体内而不觉,伺机发病且多变,严重影响DM的发生发展进程[51]。结合目前的论述,中医界广泛认为“糖毒”具有以下特点:1)弥散全身,缠绵难解:DM是慢性进展性疾病,病程长久。多数患者血糖长期处于较高水平,“糖毒(血液中过多的葡萄糖)”与精微并行,混淆其中,随气血运行,弥散全身,隐匿于各个脏腑之中,极难消散。2)其性火热,易伤阴耗气:糖毒致病多出现以多饮、多尿、多食、消瘦“三多一少”的典型症状,实属火热之象。因此,可将其病性归结为阳邪。糖毒毒性燥烈,耗伤阴液,日久阴损及阳,终致气阴两伤。同样的是,根据“代谢记忆”的定义与特点,“代谢记忆”所引发的并发症涉及多种器官,且往往存在数十年之久,难以消散,这与“糖毒”弥散全身,缠绵难解的特点相一致。此外,“代谢记忆”现象是糖尿病初期由于未及时控制血糖而引起的多个器官损伤,这与“糖毒”损伤脏腑之气的特点具有一定的相似性。
《丹溪心法》所云:“热伏于下,肾虚受之。”留于肾中之“糖毒”耗伤肾中元气,导致肾脏功能衰退(即概括为“糖毒损肾”)。此外,经过数十年进展,致使肾中精气持续损伤,封藏失司,精微从尿中漏出,导致尿浊;肾蒸腾气化无力,气不化水,水液不能循其道而行,泛溢肌肤,发为水肿,由此形成一个“量变引起质变”的病理过程。《抱朴子·疾廖》云:“积微致著。”是指微不足道的事物,经过长期积累,就会变得显著。由此可见,DKD相关“代谢记忆”的这种量变引起质变的过程可以被概括为“积微致著”。因此,结合中医古代文献记载,病机理论探讨,证候研究调查,临床疗效验证,认为“糖毒损肾、积微致著”(糖毒在肾脏缠绵不去,耗伤肾气,终致消肾)可被理解为DKD相关“代谢记忆”形成的中医病机。虽然“糖毒”致病深重、顽固复杂,但其还应属“本虚标实”之证,因虚致实,虚实相兼,应以“补肾填精、祛浊解毒”治之。
4 展望:促进“代谢记忆”的消除——中医药治疗DKD的新思路 4.1 “代谢记忆”现象是当前糖尿病治疗一大挑战目前因为“代谢记忆”现象的存在,导致糖尿病患者在血糖持续稳定在正常水平后,其慢性并发症仍然会继续发生发展,难以逆转。所以“代谢记忆”现象成为了西医治疗糖尿病及其并发症的一大挑战。当前为了应对这一挑战,医学界正在探索多种干预策略,包括使用新型的抗DM药物来预防或逆转“代谢记忆”的进展。钠-葡萄糖共转运蛋白2(SGLT2)是一种在近端小管基底膜上的协同转运蛋白,它利用Na-K ATP酶产生的钠浓度梯度以1∶1的比例转运钠和葡萄糖。SGLT2抑制剂通过阻断这种转运作用,减少近端小管对葡萄糖的重吸收,促进尿葡萄糖排泄,从而降低血糖水平,且与传统降糖药物相比,低血糖的风险更低[52]。研究表明,SGLT1/2抑制剂根皮苷干预可以降低Na-K ATP酶活性,抑制耗氧量的增加,并改善了肾皮质氧合。另外,SGLT2抑制剂还可以阻止近端小管中葡萄糖的细胞内流入减少了线粒体损伤,通过抑制氧化应激导致抗炎和抗纤维化结果[53]。来自意大利大型临床注册处(即AMD年鉴)的数据显示,早期使用SGLT2抑制剂有助于缓解DKD患者的“代谢记忆”现象,改善相关结局指标[54]。由此可见,通过研究干预DKD相关“代谢记忆”的手段,有助于延缓DKD进展,具有一定的科学价值。如果可以利用分子生物学技术,持续深入研究,有望在DKD的前沿领域取得突破性进展,为该领域的科学发展作出贡献。
4.2 中西医并举逆转“代谢记忆”现象体现了“既病防变”思路近年来,中医药在改善糖尿病患者症状及预防、治疗并发症所展现的独特作用,一直是学术界研究的重点所在。《医说》有言:“夫圣人治未病之病,知未来之疾,此其良也。”同样如《金匮要略》所云:“见肝之病,知肝传脾,当先实脾。”这体现了中医“治未病”中“既病防变”的诊疗思路。随着DM的持续发展,长期高血糖将对身体各系统造成广泛损害,若不及时加以控制进而会引发一系列并发症。因此,如何在DM发生发展时,消除“代谢记忆”,控制住疾病进展到并发症期,是中医药治疗DM及其并发症方面独特优势的体现,也是中医药恪守“既病防变”思路的展示。中医药在治疗DKD相关“代谢记忆”方面的研究逐渐增多。益气养阴活血方由黄芪、女贞子、葛根、丹参、制大黄等组成,临床治疗DKD疗效较好,体内实验表明益气养阴活血方可能抑制P300,同时刺激SIRT1表达,并通过组蛋白乙酰化修饰改变抑制炎症相关基因转录,减轻NRK-52E细胞凋亡及肾损伤,改善“代谢记忆”[55]。而在针对DKD患者治疗的临床研究中,通过中药联合西药治疗手段的临床有效率高于对照组,同时显著降低血肌酐、24 h尿蛋白定量、尿素氮、尿白蛋白排泄率等肾损伤指标水平,提示中西医联合治疗在改善DKD方面具有更好的疗效,能够减轻肾损伤、控制血糖,并且具有一定的安全性[56]。因此,在研究中医药改善DKD相关“代谢记忆”的机制中,通过中医药联合西药的治疗策略符合临床诊疗模式,可以更好地契合临床诊疗思维。
由此可见,中医药在治疗DKD方面有整体调节和个体化治疗相结合的特点,且治疗手段多样,结合西医可起到协同增效、改善症状、延缓病情的效果。而当今医学界对DKD相关“代谢记忆”的研究方兴未艾。文章首先通过介绍“代谢记忆”现象发现的由来,又探讨了DKD“代谢记忆”的调控机制,包括细胞衰老、氧化应激及炎症反应。目前已被广泛证实,表观遗传修饰是引发“代谢记忆”形成的重要机制,在调节DM并发症和“代谢记忆”相关的生理和病理过程中起着关键作用[11]。但是不论表观遗传修饰,还是细胞衰老、氧化应激及炎症反应这些机制之间其实有着错综复杂的关系,不同机制相互之间也存在交叉干扰。因此,对于“代谢记忆”机制的深入理解以及相关靶点的识别和研究,依旧是未来研究需要深入挖掘的方向。
| [1] |
ZHANG X Q, ZHANG J L, REN Y, et al. Unveiling the pathogenesis and therapeutic approaches for diabetic nephropathy: Insights from panvascular diseases[J]. Frontiers in Endocrinology, 2024, 15: 1368481. DOI:10.3389/fendo.2024.1368481 |
| [2] |
yang J, LIU Z S. Mechanistic pathogenesis of endothelial dysfunction in diabetic nephropathy and retinopathy[J]. Frontiers in Endocrinology, 2022, 13: 816400. DOI:10.3389/fendo.2022.816400 |
| [3] |
中华医学会肾脏病学分会专家组. 糖尿病肾脏疾病临床诊疗中国指南[J]. 中华肾脏病杂志, 2021, 37(3): 50. |
| [4] |
Epidemiology of Diabetes Interventions and Complications Research Group. Epidemiology of Diabetes Interventions and Complications(EDIC). Design, implementation, and preliminary results of a long-term follow-up of the Diabetes Control and Complications Trial cohort[J]. Diabetes Care, 1999, 22(1): 99-111. DOI:10.2337/diacare.22.1.99 |
| [5] |
Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33). UK Prospective Diabetes Study(UKPDS) Group[J]. Lancet, 1998, 352(9131): 837-853. DOI:10.1016/S0140-6736(98)07019-6 |
| [6] |
曾丽红, 李霖芝, 岳仁宋. 岳仁宋从"糖毒-玄府-络脉"理论辨治糖尿病足经验[J]. 成都中医药大学学报, 2021, 44(3): 40-43. |
| [7] |
HOLMAN R R, PAUL S K, BETHEL M A, et al. 10-year follow-up of intensive glucose control in type 2 diabetes[J]. New England Journal of Medicine, 2008, 359(15): 1577. DOI:10.1056/NEJMoa0806470 |
| [8] |
GAEDE P, VEDEL P, LARSEN N, et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes[J]. New England Journal of Medicine, 2003, 348(5): 383-393. DOI:10.1056/NEJMoa021778 |
| [9] |
DONG H, SUN Y Z, NIE L, et al. Metabolic memory: Mechanisms and diseases[J]. Signal Transduction and Targeted Therapy, 2024, 9(1): 38. DOI:10.1038/s41392-024-01755-x |
| [10] |
VAN RAALTE D H, BJORNSTAD P, CHERNEY D Z I, et al. Combination therapy for kidney disease in people with diabetes mellitus[J]. Nature Reviews Nephrology, 2024, 20(7): 433-446. DOI:10.1038/s41581-024-00827-z |
| [11] |
CHEN Z, NATARAJAN R. Epigenetic modifications in metabolic memory: What are the memories, and can we erase them?[J]. American Journal of Physiology Cell Physiology, 2022, 323(2): C570-C582. DOI:10.1152/ajpcell.00201.2022 |
| [12] |
HERNANDEZ-SEGURA A, NEHME J, DEMARIA M. Hallmarks of cellular senescence[J]. Trends in Cell Biology, 2018, 28(6): 436-453. DOI:10.1016/j.tcb.2018.02.001 |
| [13] |
GALLUZZI L, MYINT M. Cell death and senescence[J]. Journal of Translational Medicine, 2023, 21(1): 425. DOI:10.1186/s12967-023-04297-y |
| [14] |
MOUJALLED D, STRASSER A, LIDDELL J R. Molecular mechanisms of cell death in neurological diseases[J]. Cell Death and Differentiation, 2021, 28(7): 2029-2044. DOI:10.1038/s41418-021-00814-y |
| [15] |
易香伶, 何娅妮, 陈客宏. 肾小管上皮细胞应激性衰老在糖尿病肾病中的研究进展[J]. 四川大学学报(医学版), 2023, 54(6): 1085-1090. |
| [16] |
THOMSON S C, VALLON V, BLANTZ R C. Kidney function in early diabetes: The tubular hypothesis of glomerular filtration[J]. American Journal of Physiology Renal Physiology, 2004, 286(1): F8-15. DOI:10.1152/ajprenal.00208.2003 |
| [17] |
AL-DABET M M, SHAHZAD K, ELWAKIEL A, et al. Reversal of the renal hyperglycemic memory in diabetic kidney disease by targeting sustained tubular p21 expression[J]. Nature Communications, 2022, 13(1): 5062. DOI:10.1038/s41467-022-32477-9 |
| [18] |
JONES P A. Functions of DNA methylation: Islands, start sites, gene bodies and beyond[J]. Nature Reviews Genetics, 2012, 13(7): 484-492. DOI:10.1038/nrg3230 |
| [19] |
陈林娜, 张鹏, 王汉民. DNA甲基化与糖尿病肾病的研究进展[J]. 医学研究杂志, 2019, 48(12): 11-13, 132. |
| [20] |
JIN L, NIU C, NI Y L. Correlation between peripheral blood α1-MG, DNMT1 expression, and the severity of diabetic nephropathy renal pathological damage[J]. Medicine, 2023, 102(42): e35409. DOI:10.1097/MD.0000000000035409 |
| [21] |
GEORGAKILAS A G, MARTIN O A, BONNER W M. p21:A two-faced genome guardian[J]. Trends in Molecular Medi- cine, 2017, 23(4): 310-319. DOI:10.1016/j.molmed.2017.02.001 |
| [22] |
TAMPE B, TAMPE D, MÜLLER C A, et al. Tet3-mediated hydroxymethylation of epigenetically silenced genes contributes to bone morphogenic protein 7-induced reversal of kidney fibrosis[J]. Journal of the American Society of Neph- rology, 2014, 25(5): 905-912. DOI:10.1681/ASN.2013070723 |
| [23] |
HASEGAWA K, WAKINO S, SIMIC P, et al. Renal tubular Sirt1 attenuates diabetic albuminuria by epigenetically suppressing Claudin-1 overexpression in podocytes[J]. Nature Medicine, 2013, 19(11): 1496-1504. DOI:10.1038/nm.3363 |
| [24] |
GOLDFINE A B, SHOELSON S E. Therapeutic approaches targeting inflammation for diabetes and associated cardiovascular risk[J]. Journal of Clinical Investigation, 2017, 127(1): 83-93. DOI:10.1172/JCI88884 |
| [25] |
PÉREZ-MORALES R E, DEL PINO M D, VALDIVIELSO J M, et al. Inflammation in diabetic kidney disease[J]. Nephron, 2019, 143(1): 12-16. DOI:10.1159/000493278 |
| [26] |
DONATE-CORREA J, MARTÍN-NǦÑEZ E, MUROS-DE-FUENTES M, et al. Inflammatory cytokines in diabetic nephropathy[J]. Journal of Diabetes Research, 2015, 2015: 948417. |
| [27] |
GAUER J S, AJJAN R A, ARINS R A S. Platelet-Neutrophil Interaction and Thromboinflammation in Diabetes: Considerations for Novel Therapeutic Approaches[J]. Journal of the American Heart Association, 2022, 11(20): e027071. DOI:10.1161/JAHA.122.027071 |
| [28] |
LIU Y J, WANG W K, ZHANG J T, et al. JAK/STAT signaling in diabetic kidney disease[J]. Frontiers in Cell and Developmental Biology, 2023, 11: 1233259. DOI:10.3389/fcell.2023.1233259 |
| [29] |
TANASE D M, GOSAV E M, ANTON M I, et al. Oxidative stress and NRF2/KEAP1/ARE pathway in diabetic kidney disease(DKD): New perspectives[J]. Biomolecules, 2022, 12(9): 1227. DOI:10.3390/biom12091227 |
| [30] |
NEDOSUGOVA L V, MARKINA Y V, BOCHKAREVA L A, et al. Inflammatory mechanisms of diabetes and its vascular complications[J]. Biomedicines, 2022, 10(5): 1168. DOI:10.3390/biomedicines10051168 |
| [31] |
PRATTICHIZZO F, GIULIANI A, SABBATINELLI J, et al. Prevalence of residual inflammatory risk and associated clinical variables in patients with type 2 diabetes[J]. Diabetes, Obesity & Metabolism, 2020, 22(9): 1696-1700. |
| [32] |
BLÉRIOT C, DALMAS É, GINHOUX F, et al. Inflammatory and immune etiology of type 2 diabetes[J]. Trends in Immunology, 2023, 44(2): 101-109. DOI:10.1016/j.it.2022.12.004 |
| [33] |
DING Q Y, GAO Z Z, CHEN K Y, et al. Inflammation-related epigenetic modification: The bridge between immune and metabolism in type 2 diabetes[J]. Frontiers in Immunology, 2022, 13: 883410. DOI:10.3389/fimmu.2022.883410 |
| [34] |
MOSSEL D M, MOGANTI K, RIABOV V, et al. Epigenetic regulation of S100A9 and S100A12 expression in monocyte-macrophage system in hyperglycemic conditions[J]. Frontiers in Immunology, 2020, 11: 1071. DOI:10.3389/fimmu.2020.01071 |
| [35] |
THIEM K, KEATING S T, NETEA M G, et al. Hyperglycemic memory of innate immune cells promotes in vitro proinflammatory responses of human monocytes and murine macrophages[J]. Journal of Immunology(Baltimore, Md, 2021, 206(4): 807-813. |
| [36] |
SUN Y P, ZHANG H Y, QIU T, et al. Epigenetic regulation of mesenchymal stem cell aging through histone modifications[J]. Genes & Diseases, 2023, 10(6): 2443-2456. |
| [37] |
MAO R F, WU Y Y, MING Y, et al. Enhancer RNAs: A missing regulatory layer in gene transcription[J]. Science China Life Sciences, 2019, 62(7): 905-912. DOI:10.1007/s11427-017-9370-9 |
| [38] |
MIAO F, CHEN Z, GENUTH S, et al. Evaluating the role of epigenetic histone modifications in the metabolic memory of type 1 diabetes[J]. Diabetes, 2014, 63(5): 1748-1762. DOI:10.2337/db13-1251 |
| [39] |
Diabetes Control and Complications Trial Study Research Group. Mortality in type 1 diabetes in the DCCT/EDIC versus the general population[J]. Diabetes Care, 2016, 39(8): 1378-1383. DOI:10.2337/dc15-2399 |
| [40] |
CHEN Z, MIAO F, PATERSON A D, et al. Epigenomic profiling reveals an association between persistence of DNA methylation and metabolic memory in the DCCT/EDIC type 1 diabetes cohort[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(21): E3002-E3011. |
| [41] |
YOSHIKAWA T, YOU F. Oxidative stress and bio-regulation[J]. International Journal of Molecular Sciences, 2024, 25(6): 3360. DOI:10.3390/ijms25063360 |
| [42] |
JHA J C, BANAL C, CHOW B S M, et al. Diabetes and kidney disease: Role of oxidative stress[J]. Antioxidants & Redox Signaling, 2016, 25(12): 657-684. |
| [43] |
DAI Y L, QUAN J J, XIONG L L, et al. Probiotics improve renal function, glucose, lipids, inflammation and oxidative stress in diabetic kidney disease: A systematic review and meta-analysis[J]. Renal Failure, 2022, 44(1): 862-880. DOI:10.1080/0886022X.2022.2079522 |
| [44] |
KACHAEV Z M, LEBEDEVA L A, KOZLOV E N, et al. Interplay of mRNA capping and transcription machineries[J]. Bioscience Reports, 2020, 40(1): BSR20192825. DOI:10.1042/BSR20192825 |
| [45] |
ZHANG P J, LI T, WU X Y, et al. Oxidative stress and diabetes: Antioxidative strategies[J]. Frontiers of Medicine, 2020, 14(5): 583-600. DOI:10.1007/s11684-019-0729-1 |
| [46] |
HALLIWELL B. Reactive species and antioxidants. Redox biology is a fundamental theme of aerobic life[J]. Plant Physiology, 2006, 141(2): 312-322. DOI:10.1104/pp.106.077073 |
| [47] |
BRYAN H K, OLAYANJU A, GOLDRING C E, et al. The Nrf2 cell defence pathway: Keap1-dependent and-independent mechanisms of regulation[J]. Biochemical Pharmacology, 2013, 85(6): 705-717. DOI:10.1016/j.bcp.2012.11.016 |
| [48] |
XUE M Z, RABBANI N, MOMIJI H, et al. Transcriptional control of glyoxalase 1 by Nrf2 provides a stress-responsive defence against dicarbonyl glycation[J]. Biochemical Journal, 2012, 443(1): 213-222. DOI:10.1042/BJ20111648 |
| [49] |
PERGOLA P E, KRAUTH M, WARREN HUFF J, et al. Effect of bardoxolone methyl on kidney function in patients with T2D and Stage 3b-4 CKD[J]. American Journal of Nephrology, 2011, 33(5): 469-476. DOI:10.1159/000327599 |
| [50] |
CHIN M P, WROLSTAD D, BAKRIS G L, et al. Risk factors for heart failure in patients with type 2 diabetes mellitus and stage 4 chronic kidney disease treated with bardoxolone methyl[J]. Journal of Cardiac Failure, 2014, 20(12): 953-958. DOI:10.1016/j.cardfail.2014.10.001 |
| [51] |
张进进, 郑仲华, 李硕. 从糖毒伤络理论探讨糖尿病肾病的治疗机制[J]. 中医研究, 2018, 31(7): 48-49. DOI:10.3969/j.issn.1001-6910.2018.07.21 |
| [52] |
NEUEN B L, HEERSPINK H J L, VART P, et al. Estimated lifetime cardiovascular, kidney, and mortality benefits of combination treatment with SGLT2 inhibitors, GLP-1 receptor agonists, and nonsteroidal MRA compared with conventional care in patients with type 2 diabetes and albuminuria[J]. Circulation, 2024, 149(6): 450-462. DOI:10.1161/CIRCULATIONAHA.123.067584 |
| [53] |
TANAKA S, SUGIURA Y, SAITO H, et al. Sodium-glucose cotransporter 2 inhibition normalizes glucose metabolism and suppresses oxidative stress in the kidneys of diabetic mice[J]. Kidney International, 2018, 94(5): 912-925. DOI:10.1016/j.kint.2018.04.025 |
| [54] |
CERIELLO A, LUCISANO G, PRATTICHIZZO F, et al. The legacy effect of hyperglycemia and early use of SGLT-2 inhibitors: A cohort study with newly-diagnosed people with type 2 diabetes[J]. The Lancet Regional Health-Europe, 2023, 31: 100666. DOI:10.1016/j.lanepe.2023.100666 |
| [55] |
章文星, 杜月光, 柴可夫. 益气养阴活血方对高糖诱导的NRK-52E细胞代谢记忆的影响[J]. 浙江中西医结合杂志, 2018, 28(7): 5. |
| [56] |
LI H D, DONG S N, LIU Y S, et al. Efficacy and safety of "Bushen Huoxue therapy"-based combined Chinese and western medicine treatment for diabetic kidney disease: An updated meta-analysis of 2105 patients[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022: 3710074. |
 2025, Vol. 44
2025, Vol. 44




