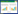文章信息
- 杨枫, 王传旭, 吴志远, 等.
- YANG Feng, WANG Chuanxu, WU Zhiyuan, et al.
- 矢志方激活Sirt1-Foxo1通路调控内质网应激相关蛋白改善高尿酸血症小鼠肾损伤
- Shizhi Prescription regulating endoplasmic reticulum stress-related proteins to ameliorate renal injury in hyperuricemic mice by activating Sirt1-Foxo1 pathway
- 天津中医药, 2023, 40(9): 1160-1167
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1160-1167
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.13
-
文章历史
- 收稿日期: 2023-06-08
高尿酸血症(HUA)是由于嘌呤代谢紊乱导致血清尿酸(UA)升高的代谢综合征,对人体心脑血管、关节、肾脏等器官造成损害[1-2]。随着人们生活水平的提高,HUA的发病率逐年升高,UA长期堆积在肾脏会引起肾小管间质纤维化,从而引发UA性肾病[3]。临床一线降UA药物如黄嘌呤氧化酶抑制剂非布司他、别嘌呤醇,促进UA排泄药物苯溴马隆等,长期服用存在一定副作用、血清UA控制不佳等问题[4]。
沉默信息调节因子1(Sirt1)/叉头转录因子1(Foxo1)信号通路与肾脏病理生理发展密切相关。Sirt1在肾脏中广泛存在,激活Sirt1可抑制Foxo1乙酰化水平,对肾脏起保护作用。Sirt1表达增加可减轻草酸钙晶体诱导的肾损伤[5],缓解脂多糖所导致的氧化应激引起的肾损伤[6]。内质网应激(ERS)是维持细胞内稳态的重要细胞器,肾小管上皮细胞损伤是一种病理和生理的改变,在HUA早期和进展期发挥关键作用[7]。在正常情况下,适度ERS能保护细胞活性,如果长时间高UA刺激则会超出内质网代偿能力,造成细胞损伤[8]。
矢志方是上海中医药大学附属曙光医院肾病科临床经验方。临床疗效较好,能显著降低痰浊瘀阻型HUA的UA水平[9]。前期大量基础实验研究表明,矢志方能降低HUA小鼠和HUA大鼠UA水平、改善HUA小鼠和HUA大鼠肾功能[10-13]。基于本课题组前期研究基础,本实验通过建立HUA小鼠模型,观察基于Sirt1-Foxo1通路矢志方对HUA小鼠肾组织和高UA诱导HK2细胞ERS相关蛋白表达的影响,以期为矢志方的临床应用提供更多实验依据。
1 实验材料 1.1 动物选取32只8周龄SPF级雄性BALB/c小鼠,体质量12~22 g,购自上海斯莱克实验动物,动物许可证号SCXK(沪)2017-0005,伦理证号PZSHUTCM211227011。在上海中医药大学实验动物中心饲养,温度25 ℃左右,湿度45%左右,12 h光照,普通饮食饮水喂养。
1.2 实验细胞人肾小管上皮细胞HK2,购自中国科学院细胞库。
1.3 实验药物动物用药:矢志方(车前子30 g,芥子15 g,王不留行15 g,冬葵子15 g),饮片购自上海中医药大学附属曙光医院,并委托国家中药制药工程技术研究中心制备成中药复方颗粒剂(1 g颗粒相当于原方20 g),用蒸馏水配制成70 mg/mL药液。非布司他片,40 mg/片,江苏恒瑞医药股份有限公司,批号H20130081,用蒸馏水配制成0.75 mg/mL药液。
矢志方冻干粉制作流程:称取炒王不留行、炒芥子各3.6 kg,炒车前子7.2 kg,冬葵子3.6 kg,混合均匀,打粉,粉碎后加入药材10倍体积纯净水包煎,先煮1 h,过滤,再加8倍水浸泡1 h,加热回流提取2次,每次1 h。最终得到冻干粉0.9 kg。
细胞用药矢志方溶液配制:50 mL试管中加入10 mL含10%胎牛血清(FBS)、1%P/S的F12/DMEM完全培养基,称取矢志方干粉600 mg,加入到试管中,细胞裂解仪30%功率5 min促进干粉溶解,矢志方溶液终浓度为60 mg/mL。
UA配置:称取100 mg UA加入10 mL双蒸水,震荡混匀充分溶解后滤过使用,UA溶液终浓度为10 mg/mL。
1.4 主要试剂与仪器氧嗪酸钾、羧甲基纤维素钠(CMCC-Na),上海麦克林生化科技有限公司,货号分别为P831461、C10097951;UA,美国Sigma公司,货号u2875-5 g;Sirt1,美国CST公司(货号8469s);内质网跨膜蛋白肌醇酶1α(IRE1α),美国CST公司(货号3294s)、武汉Abclonal公司(货号A17940);天冬氨酸特异性半胱氨酸蛋白酶(Caspase)12,美国Signalway Antibody公司(货号48277)、武汉Abclonal公司(货号A22864);增强子结合蛋白同源蛋白(Chop),美国CST公司(货号2895s)、武汉Abclonal公司(货号A113466);Foxo1,美国CST公司(货号2880s);GAPDH,美国Proteintech公司(货号60004-I-Ig);α-Tubulin,上海碧云天公司,货号AF2827;HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG,上海碧云天公司,货号分别为A0216、A0208;PVDF膜,美国Millipore公司,货号IPVH00005。离心机,美国Beckman公司,型号Avanti J-E;凝胶成像系统,上海天能生命科学有限公司,型号Tanon-5200;生物组织冷冻包埋机,浙江省金华市科迪仪器设备有限公司,型号KD-BM;烘片机,浙江省金华市科迪仪器设备有限公司,型号KD-H;酶标仪,美国BioTek公司,型号Synergy 2;组织匀浆器,上海净信科技有限公司,型号JY-24;显微镜,日本奥林巴斯公司,型号CX33。
2 实验方法 2.1 动物分组、造模与给药造模及给药方法参考文献[8],32只小鼠适应性饲养1周后,随机分为正常组、模型组、非布司他组和矢志方组,每组8只。正常组用同等体积生理盐水灌胃,其余各组采用250 mg/kg氧嗪酸钾溶液灌胃建立HUA小鼠模型。4 h后给予药物干预即非布司他组灌胃非布司他药液6 mg/kg,矢志方组灌胃矢志方药液562.5 mg/kg,参考《中药药理实验方法学》的人与小鼠药物换算方式和本课题组前期实验,每只小鼠每10 g灌胃0.2 mL,每日1次,正常组和模型组予等体积生理盐水灌胃,造模与给药同时进行,连续2周。
2.2 细胞培养与造模方法将HK2细胞用含10% FBS和1%双抗的DMEM/F12培养基于5%CO2、37 ℃恒温培养箱中培养,细胞密度为90%时进行细胞传代,取对数生长期细胞进行细胞铺板,细胞贴壁后用含0.5%FBS的DMEM/F12培养基饥饿处理12 h,再进行相应干预,干预24 h后处理细胞进行后续实验。将细胞分为正常组,模型组(200 μg/mL UA),中药组(200 μg/mL UA+300 μg/mL失志方)。
2.3 取材第14日给药结束后,0.8%戊巴比妥钠腹腔注射麻醉小鼠,摘取双侧肾脏分别用于病理观察、蛋白免疫印迹法(Western blot)实验和免疫荧光染色。
2.4 病理观察小鼠肾脏组织经4%多聚甲醛组织固定液固定24 h,梯度脱水、浸蜡、包埋,4 μm厚度切片,37 ℃烤片12 h,然后进行苏木精-伊红(HE)染色、Masson染色,中性树脂封片,显微镜下观察小鼠肾脏组织病理形态。
2.5 Western blot检测取20 mg小鼠肾组织,加入RIPA裂解液200 μL,匀浆机65 Hz匀浆1 min,4 ℃、12 000 rpm离心15 min,离心半径6 cm。BCA法测定蛋白浓度,加入上样缓冲液和生理盐水配制成浓度为40 μg/μL的等量蛋白样品。上样,120 V电泳1 h,300 mA、1 h 30 min转至PVDF膜,5%脱脂奶粉室温封闭1 h,分别加入IRE1α一抗(1∶1 000)、Sirt1一抗(1∶1 000)、Foxo1一抗(1∶1 000)、Caspase 12一抗(1∶1 000)、Chop一抗(1∶1 000)、α-Tubulin一抗(1∶1 000)、GAPDH一抗(1∶5 000),4 ℃孵育过夜;PBST洗膜3次,加入HRP标记的山羊抗小鼠IgG(1∶1 000)、山羊抗兔IgG(1∶1 000),室温孵育1 h;PBST洗膜3次,ECL化学发光法显影,凝胶成像系统拍摄。以GAPDH和α-Tubulin为内参,计算目的蛋白相对表达量。
2.6 免疫荧光染色细胞经爬片、干预结束后,4%多聚甲醛室温固定爬片细胞30 min,室温通透细胞20 min,加入1% BSA室温封闭60 min,加入稀释的IRE1α一抗(1∶200)、Sirt1一抗(1∶1 000)、Foxo1一抗(1∶1 000)、Caspase 12一抗(1∶400)、Chop一抗(1∶400),4 ℃孵育过夜;加入荧光二抗(1∶500),避光孵育1 h,加入DAPI染细胞核5 min,甘油封片,荧光显微镜下观察。
2.7 免疫组化染色肾组织石蜡切片脱蜡至水,抗原修复,3%牛血清白蛋白溶液(BSA)室温封闭30 min,加入IRE1α一抗(1∶100)、Sirt1一抗(1∶100)、Foxo1一抗(1∶100)、Caspase12一抗(1∶100)、Chop一抗(1∶100)。4 ℃孵育过夜,加二抗室温孵育50 min,二氨基联苯胺(DAB)显色,中性树脂封片,光镜下观察,以棕黄色颗粒为阳性表达。
3 统计学方法采用SPSS22.0统计软件和Image J 1.8软件进行分析。实验数据以均数±标准差(x±s)表示,多重比较采用单因素方差分析(one-way ANOVA)。P<0.05表示有统计学意义。
4 结果 4.1 矢志方对模型小鼠肾组织病理形态的影响与正常组比较,模型组小鼠肾组织结构紊乱,肾小管管腔扩张、管壁变薄,肾间质炎性细胞浸润,大量蓝色胶原纤维沉积;与模型组比较,矢志方组和非布司他组小鼠肾小管管腔扩张、炎性细胞浸润、蓝色胶原纤维集聚程度减少。见图 1。
|
| 图 1 各组小鼠肾组织形态(×400) Fig. 1 Pathological changes of mouse kidney tissue in each group(×400) |
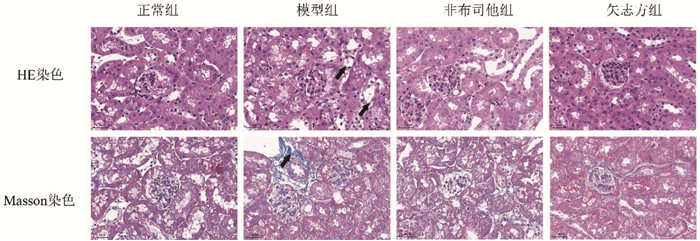
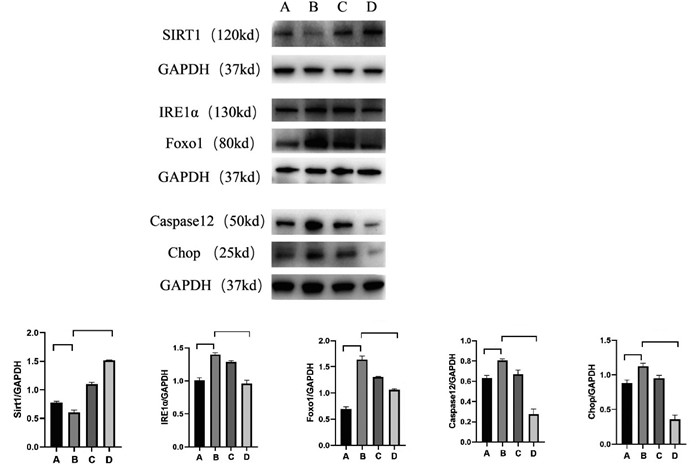
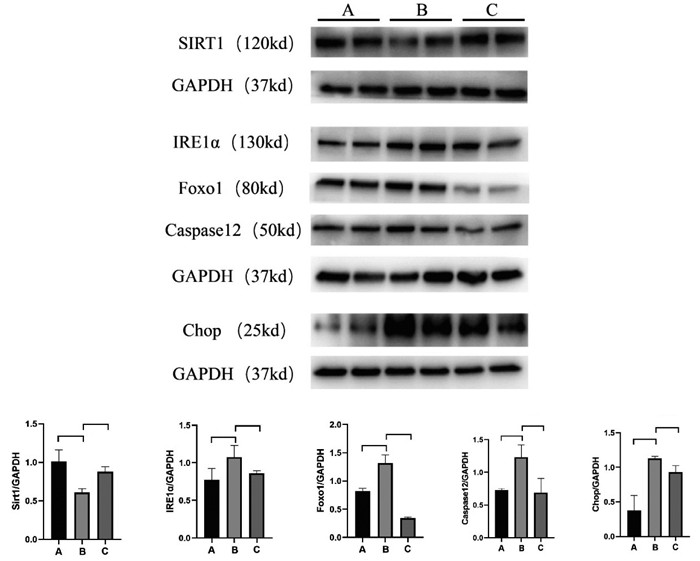
Western blot结果显示,与正常组比较,模型组小鼠肾组织IRE1α、Foxo1、Caspase12、Chop蛋白表达显著升高(P<0.01或P<0.001),Sirt1蛋白表达显著降低(P<0.001);与模型组比较,非布司他组小鼠肾组织和矢志方组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop蛋白表达显著降低(P<0.001),Sirt1蛋白表达显著升高(P<0.001)。细胞Western blot结果与HUA小鼠肾组织Western blot结果趋势一致,见图 2,图 3。
|
| 注:A.正常组,B.模型组,C.矢志方组;与正常组比较,**P<0.01,***P<0.001;与模型组比较,#P<0.05,###P<0.001。 图 2 各组HK2细胞Sirt1、IRE1α、Foxo1、Caspase 12、Chop蛋白表达情况(x±s) Fig. 2 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in HK2 cells of each group(x±s) |
|
| 注:A.正常组,B.模型组,C.非布司他组,D.矢志方组;与正常组比较,**P<0.01,***P<0.001;与模型组比较,###P<0.001。 图 3 各组小鼠肾组织Sirt1、IRE1α、Foxo1、Caspase 12、Chop蛋白表达情况(x±s) Fig. 3 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in mouse kidney tissue of each group(x±s) |
免疫组化染色结果显示,与正常组比较,模型组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop表达显著升高(P<0.01或P<0.001),Sirt1表达显著降低(P<0.001);与模型组比较,非布司他组和矢志方组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop表达显著降低(P<0.05,P<0.01或P<0.001),Sirt1表达显著升高(P<0.05)。见图 4。
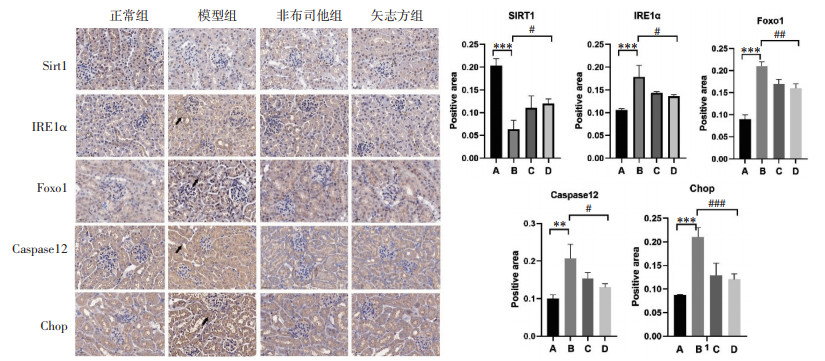
|
| 注:A.正常组,B.模型组,C.非布司他组,D.矢志方组;与正常组比较,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001。 图 4 各组小鼠肾组织Sirt1、IRE1α、Foxo1、Caspase12、Chop阳性表达情况(免疫组化染色,×400) Fig. 4 Postive expressions of Sirt1、IRE1α、Foxo1、Caspase12、Chop in mouse kidney tissue of each group (Immunohistochemical staining, ×400) |
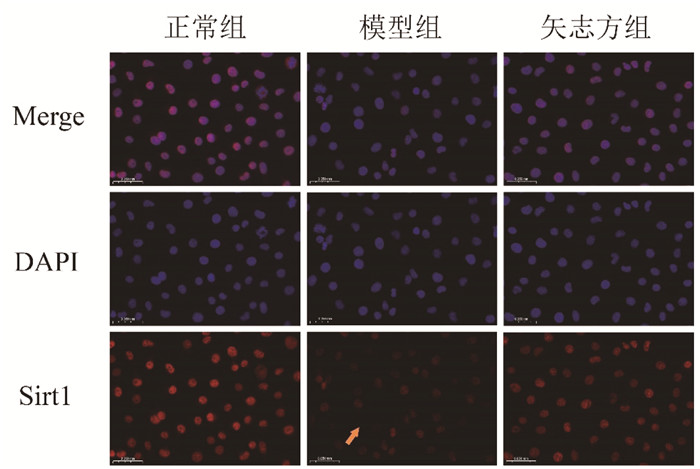
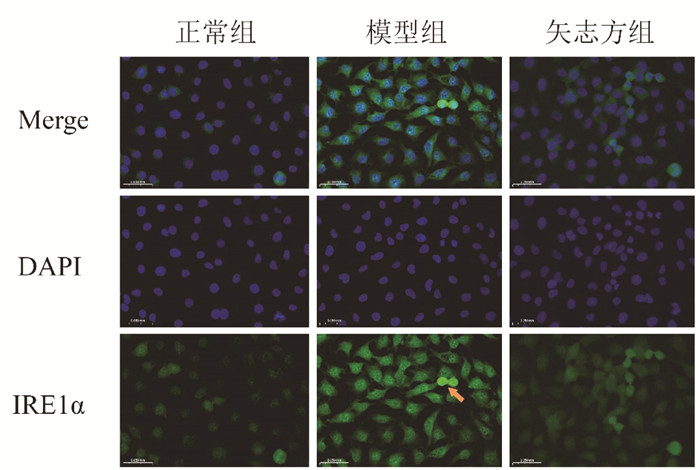
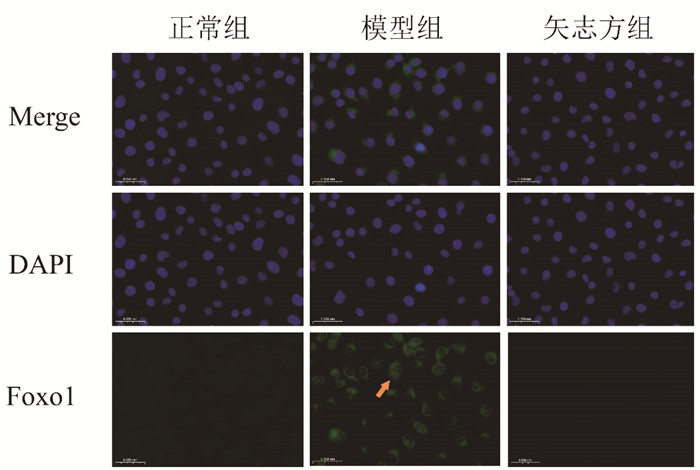
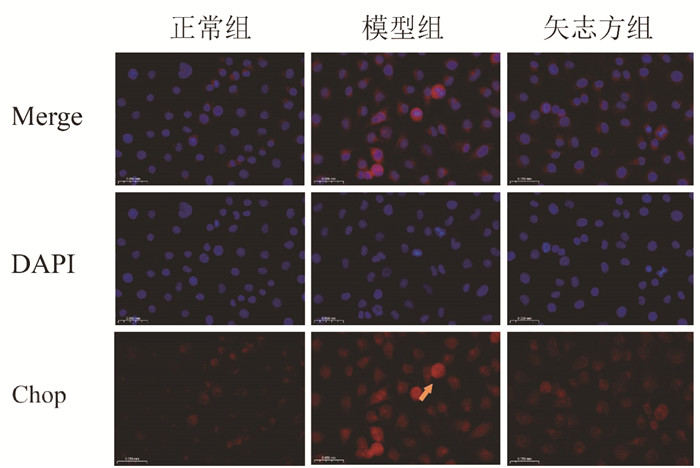
免疫荧光染色结果显示,与正常组比较,模型组细胞IRE1α、Foxo1、Caspase 12、Chop表达显著升高,Sirt1表达显著降低;与模型组比较,矢志方组细胞IRE1α、Foxo1、Caspase 12、Chop表达显著降低,Sirt1表达显著升高。见图 5-9。
|
| 图 5 各组HK2细胞Sirt1阳性表达(免疫荧光染色,×400) Fig. 5 Postive expressions of Sirt1 in HK2 cells of each group (Immunofluorescence staining, ×400) |
|
| 图 6 各组HK2细胞IRE1α阳性表达(免疫荧光染色,×400) Fig. 6 Postive expressions of IRE1α in HK2 cells of each group(Immunofluorescence staining, ×400) |
|
| 图 7 各组HK2细胞Foxo1阳性表达(免疫荧光染色,×400) Fig. 7 Postive expressions of Foxo1 in HK2 cells of each group(Immunofluorescence staining, ×400) |

|
| 图 8 各组HK2细胞Caspase 12阳性表达(免疫荧光染色,×400) Fig. 8 Postive expressions of Caspase 12 in HK2 cells of each group(Immunofluorescence staining, ×400) |
|
| 图 9 各组HK2细胞Chop阳性表达(免疫荧光染色,×400) Fig. 9 Postive expressions of Chop in HK2 cells of each group(Immunofluorescence staining, ×400) |
HUA引起肾损伤的机制十分复杂,主要包括氧化应激、内皮功能障碍、肾纤维化和炎症[3]。本课题组前期研究发现矢志方临床疗效显著,前期基础实验研究表明,矢志方能抑制白细胞介素-1β(IL-1β)IL-1β表达、促进有机阴离子转运蛋白1/3(OAT1/3)、肝细胞核因子1α/4α(HNF1α/4α)表达减轻HUA小鼠肾脏损伤。ERS与肾损伤密切相关[14-15],本研究中发现ERS的调节因子Sirt1在HUA小鼠肾组织中显著下调,给予矢志方干预后能上调Sirt1表达水平、矢志方还能抑制ERS、改善肾损伤和间质纤维化。因此,Sirt1和ERS可能是HUA诱导的肾间质纤维化的潜在治疗靶点。
内质网是一个表型和功能多样的传感平台,与调节蛋白沉积、脂质代谢、糖异生和钙信号传导等多种细胞功能密切相关,是维持和恢复代谢健康的重要组成部分。内质网稳态的紊乱通常被称为ERS,ERS是一种功能失衡状态,通过激活内质网激酶(PERK)/真核起始因子2α(eIF2α)途径中C/EBP同源蛋白(Chop)、IRE1α-凋亡信号调节激酶1(ASK1)-c-Jun N端激酶(JNK)通路、IRE1α-X盒结合蛋白1(XBP1)-Chop通路、激活Caspase 12通路调控细胞凋亡。轻度ERS时,内质网可通过激活未折叠蛋白反应途径(UPR)启动自噬以恢复内质网稳态,促使细胞存活;当ERS刺激过强且持续存在时,会过度诱导自噬或激活凋亡途径使细胞死亡。
UPR包括重建内质网稳态的途径以及触发凋亡的途径,即转录因子依赖和Caspase 12依赖的途径[16]。在转录因子依赖的途径中,葡萄糖调节蛋白78(GRP78)在ERS激活时与IRE1解离,IRE1α的管腔结构域感知未折叠蛋白的积累,从而导致其二聚化和自身磷酸化。这激活了其胞质内核糖核酸酶活性,启动了两个独立的事件来恢复蛋白沉积。一个是通过调节的IRE1依赖性衰变(RIDD)降解mRNAs,通过IRE1α切割并去稳定内质网定位的mRNAs,从而减少新合成的蛋白质进入内质网腔所产生的折叠负担。另一种是X盒结合蛋白-1(XB P1)mRNA的非规范特异性剪接[17],XBP1s还通过丝裂原活化蛋白激酶14(MAPK14)信号的磷酸化在蛋白质水平上受到调节[18]。UPR的IRE1α-XBP1途径是维持代谢稳态的关键因素[19-22]。在Caspase 12依赖性途径中,钙离子(Ca2+)从细胞内储存到胞质溶胶,导致钙蛋白酶转移到内质网,使Caspase 12活化,然后通过Caspase 9的激活,诱导Caspase 3依赖的凋亡途径,以促进细胞凋亡[23]。另外,IRE1通过上调Chop转录因子,一方面,活化的Chop上调B淋巴细胞瘤-2基因(Bcl-2)家族促凋亡蛋白Bax发挥促凋亡作用;另一方面,Chop促进TRAIL受体2(DR5)的转录,活化Caspase 8依赖的外源途径的细胞凋亡。表明Chop在靶向ERS激诱导的细胞凋亡中发挥了关键作用[24]。本研究发现矢志方能在体内体外下调IRE1α、Foxo1、Caspase 12、Chop蛋白表达水平,表明矢志方能通过抑制ERS缓解肾脏损伤。
Sirt1是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶,参与代谢、衰老、细胞存活、自噬和糖尿病的调节。Sirt1通过去乙酰化激活各种蛋白质和转录因子。Foxo1是其中一个被Sirt1去乙酰化的转录因子,参与细胞的氧化应激抵抗、细胞凋亡、细胞周期阻滞、胰岛素信号转导和代谢等[25]。有研究报道,Sirt1存在于细胞核中,但它可以穿梭到细胞质中,作为组蛋白的去乙酰化酶,以及许多非组蛋白靶点[26]。受Sirt11调控的Foxo转录因子的乙酰化状态可以选择性地将Foxos定向到特定的靶点,是代谢和应激反应的另一个调控途径[27]。进一步的研究报道,Foxo1被Sirt1介导的赖氨酸242、245和262的脱乙酰化激活[28]。因为到目前为止已经证明Sirt1通过调节Foxos的表达来防止ROS产生和氧化应激,但是也已经提出增加的氧化应激可以反过来控制Sirt1活性,但是Foxo参与该活性的可能性还不清楚[29]。Sirt1在调节ERS方面发挥了重要作用,它可通过调控内质网相关分子PERK、GRP78缓解ERS减轻阿霉素引起的心脏毒性[30]。本研究结果表明Sirt1在受高UA刺激后表达降低,而矢志方能显著激活Sirt1水平,改善肾脏损伤,并且下调ERS相关蛋白,说明Sirt1可通过调控ERS减轻HUA所导致的肾损伤。
综上所述,矢志方可减轻HUA小鼠肾脏损伤,其机制与激活Sirt1-Foxo1通路抑制ERS相关蛋白及下游Chop、Caspase 12蛋白表达有关。然而,HUA引发ERS,以及进一步导致肾损伤并没有完全了解,还有待进一步研究。
| [1] |
ISAKA Y, TAKABATAKE Y, TAKAHASHI A, et al. Hyperuricemia-induced inflammasome and kidney diseases[J]. Nephrology Dialysis Transplantation, 2016, 31(6): 890-896. DOI:10.1093/ndt/gfv024 |
| [2] |
石旭柳, 乔淼, 伍明江, 等. 痛风和高尿酸血症动物模型研究进展及代谢通路分析[J]. 天津中医药, 2019, 36(5): 511-515. SHI X L, QIAO M, WU M J, et al. Overview of animal models of gout and hyperuricemia and metabolic pathway analysis[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 511-515. |
| [3] |
SU H Y, YANG C, LIANG D, et al. Research advances in the mechanisms of hyperuricemia-induced renal injury[J]. Biomed Research International, 2020, 2020: 5817348. |
| [4] |
王爱华, 金玥, 吴越, 等. 具有黄嘌呤氧化酶抑制作用的中药及中成药治疗高尿酸血症研究进展[J]. 天津中医药, 2019, 36(12): 1241-1245. WANG A H, JIN Y, WU Y, et al. Research progress on treatment of gout by xanthine oxidase inhibitor in traditional Chinese medicine[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(12): 1241-1245. DOI:10.11656/j.issn.1672-1519.2019.12.23 |
| [5] |
LIU H, DUAN C, YANG X, et al. Metformin suppresses calcium oxalate crystal-induced kidney injury by promoting Sirt1 and M2 macrophage-mediated anti-inflammatory activation[J]. Signal Transduction and Targeted Therapy, 2023, 8(1): 38. DOI:10.1038/s41392-022-01232-3 |
| [6] |
PAN J, ZHU J, LI L, et al. Salidroside attenuates LPS-induced kidney injury through activation of SIRT1/Nrf2 pathway[J]. Human & Experimental Toxicology, 2023, 42: 9603271231169520. |
| [7] |
ZHENG J, GONG S, WU G, et al. Berberine attenuates uric acid-induced cell injury by inhibiting NLRP3 signaling pathway in HK-2 cells[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2023. |
| [8] |
王誉湘, 谢静晓, 张晓萍, 等. 杨桃根DMDD对高糖诱导的肾小管上皮细胞HK-2内质网应激IRE1α通路及炎症反应的抑制作用[J]. 中国药理学通报, 2023, 39(7): 1270-1275. WANG Y X, XIE J X, ZHANG X P, et al. The inhibitory effect of Averrhoa carambola DMDD on high glucose-induced endoplasmic reticulum stress IRE1α pathway and inflammation in renal tubular epithelial cell HK-2[J]. Chinese Pharmacological Bulletin, 2023, 39(7): 1270-1275. |
| [9] |
李屹, 何立群. 矢志方治疗痰浊瘀阻型高尿酸血症肾病33例[J]. 上海中医药杂志, 2011, 45(9): 41-43. LI Y, HE L Q. Treatment of 33 cases of hyperuricemic nephropathy of phlegm-blood stasis by Shizhi Decoction[J]. Shanghai Journal of Traditional Chinese Medicine, 2011, 45(9): 41-43. |
| [10] |
王传旭, 周嘉宝, 吴志远, 等. 基于IL-1β探讨矢志方对高尿酸血症小鼠肾组织OAT1/3表达的影响[J]. 中国中医药信息杂志, 2022, 29(12): 70-75. WANG C X, ZHOU J B, WU Z Y, et al. Effects of Shizhi Prescription on the expression of OAT1/3 in the renal tissue of hyperuricemic mice based on IL-1β[J]. Chinese Journal of Information on TCM, 2022, 29(12): 70-75. |
| [11] |
李瑞玲, 吴燕升, 李东东, 等. 矢志方减轻高尿酸血症大鼠肾小管损伤的作用机制研究[J]. 上海中医药杂志, 2021, 55(7): 85-90. LI R L, WU Y S, LI D D, et al. Study on protective effect and mechanism of Shizhifang Formula on renal tubular injury in hyperuricemia rats[J]. Shanghai Journal of Traditional Chinese Medicine, 2021, 55(7): 85-90. |
| [12] |
吴燕升, 谢芸, 周剑国, 等. 矢志方对高尿酸血症大鼠尿酸和脂质代谢水平的影响[J]. 中国中医药信息杂志, 2021, 28(6): 52-58. WU Y S, XIE Y, ZHOU J G, et al. Effect of Shizhi Prescription on serum uric acid and lipid metabolism level in rats of hyperuricemia[J]. Chinese Journal of Information on TCM, 2021, 28(6): 52-58. |
| [13] |
ZHOU J, WANG C, ZHANG X, et al. Shizhifang ameliorates pyroptosis of renal tubular epithelial cells in hyperuricemia through inhibiting NLRP3 inflammasome[J]. Journal of Ethnopharmacology, 317: 116777. |
| [14] |
YAN M, SHU S, GUO C, et al. Endoplasmic reticulum stress in ischemic and nephrotoxic acute kidney injury[J]. Annals of Medicine, 2018, 50(5): 381-390. |
| [15] |
KROPSKI J A, BLACKWELL T S. Endoplasmic reticulum stress in the pathogenesis of fibrotic disease[J]. Journal of Clinical Investigation, 2018, 128(1): 64-73. |
| [16] |
RON D, WALTER P. Signal integration in the endoplasmic reticulum unfolded protein response[J]. Nature Reviews Molecular Cell Biology, 2007, 8(7): 519-529. |
| [17] |
LIU X, BEAUDOIN J D, DAVISON C A, et al. A functional non-coding RNA is produced from xbp-1 mRNA[J]. Neuron, 2020, 107(5): 854-863. |
| [18] |
LEE J, SUN C, ZHOU Y, et al. p38 MAPK-mediated regulation of Xbp1s is crucial for glucose homeostasis[J]. Nature Medicine, 2011, 17(10): 1251-1260. |
| [19] |
TSUCHIYA Y, SAITO M, KADOKURA H, et al. IRE1-XBP1 pathway regulates oxidative proinsulin folding in pancreatic beta cells[J]. Journal of Cell Biology, 2018, 217(4): 1287-1301. |
| [20] |
HASSLER J R, SCHEUNER D L, WANG S, et al. The IRE1alpha/XBP1s pathway is essential for the glucose response and protection of beta Cells[J]. PLoS Biology, 2015, 13(10): e1002277. |
| [21] |
WILLIAMS K W, LIU T, KONG X, et al. Xbp1s in Pomc neurons connects ER stress with energy balance and glucose homeostasis[J]. Cell Metabolism, 2014, 20(3): 471-482. |
| [22] |
DENG Y, WANG Z V, GORDILLO R, et al. Adipocyte Xbp1s overexpression drives uridine production and reduces obesity[J]. Molecular Metabolism, 2018, 11: 1-17. |
| [23] |
PERRI E R, THOMAS C J, PARAKH S, et al. The unfolded protein response and the role of protein disulfide isomerase in neurodegeneration[J]. Frontiers in Cell and Developmental Biology, 2015, 3: 80. |
| [24] |
KAMAREHEI M, KABUDANIAN ARDESTANI S, FIROUZI M, et al. Increased expression of endoplasmic reticulum stress-related caspase-12 and CHOP in the hippocampus of EAE mice[J]. Brain Research Bulletin, 2019, 147: 174-182. |
| [25] |
SOSNOWSKA B, MAZIDI M, PENSON P, et al. The sirtuin family members SIRT1, SIRT3 and SIRT6:Their role in vascular biology and atherogenesis[J]. Atherosclerosis, 2017, 265: 275-282. |
| [26] |
DANG W. The controversial world of sirtuins[J]. Drug Discovery Today: Technologies, 2014, 12: e9-e17. |
| [27] |
HOUTKOOPER R H, PIRINEN E, AUWERX J. Sirtuins as regulators of metabolism and healthspan[J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 225-238. |
| [28] |
HARIHARAN N, MAEJIMA Y, NAKAE J, et al. Deacetylation of FoxO by Sirt1 plays an essential role in mediating starvation-induced autophagy in cardiac myocytes[J]. Circulation Research, 2010, 107(12): 1470-1482. |
| [29] |
SALMINEN A, KAARNIRANTA K, KAUPPINEN A. Crosstalk between oxidative stress and SIRT1:impact on the aging process[J]. Int J Mol Sci, 2013, 14(2): 3834-3859. |
| [30] |
孔令恒, 高佳琳, 张景, 等. 二甲双胍激活SIRT1信号抑制内质网应激减轻阿霉素引起的心脏毒性[J]. 山西医科大学学报, 2022, 53(10): 1261-1267. KONG L H, GAO J L, ZHANG J, et al. Metformin alleviates doxorubicin-induced cardiotoxicity by inhibiting endoplasmic reticulum stress via activation of SIRT1 signaling pathway[J]. Journal of Shanxi Medical University, 2022, 53(10): 1261-1267. |
 2023, Vol. 40
2023, Vol. 40