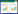文章信息
- 丘婉俐, 陈瑞晗, 赵婷婷, 等.
- QIU Wanli, CHEN Ruihan, ZHAO Tingting, et al.
- 清金益气方治疗新型冠状病毒的药效研究及潜在作用机制
- Pharmacodyamic study and potential mechanism of Qingjin Yiqi Decoction for the treatment of COVID-19
- 天津中医药, 2024, 41(10): 1315-1324
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(10): 1315-1324
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.10.15
-
文章历史
- 收稿日期: 2024-05-14
2. 广州医科大学附属第一医院, 广州呼吸健康研究院呼吸疾病国家重点实验室/国家呼吸系统疾病临床医学研究中心, 广州 511436;
3. 广州中医药大学第八临床医学院, 佛山 528051
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒感染大流行,让全世界措手不及。尽管新型冠状病毒疫苗接种人群广泛,但疫苗的效力仍会受到病毒进化和新变种出现的影响[1]。其中奥密克戎变异株的变异度严重,可进化成多个谱系,具有极强的传播性和免疫逃避能力,奥密克戎BA.1曾经是世界最广泛流行的菌株。奥密克戎变异株对疫苗、恢复期血清和大多数抗体疗法的中和活性表现出明显的抵抗力[2],对其预防和治疗的难度加大。不同毒株因突变位点不同而影响药物的效果,比如阿斯利康的恩适德(Evusheld)对奥密克戎BA.4.6变异株失去效力[3]。研究表明,多数用于新型冠状病毒防治的小分子化学药物存在明显的副作用,比如辉瑞的奈玛特韦片/利托那韦片组合药Paxlovid(Nirmatrlvir/Ritonavir)可引起明显的胃肠系统不适[4];真实生物的阿兹夫定(Azvudine)可能会使中性粒细胞绝对值降低、谷草转氨酶升高及血糖升高等[5]。除此之外,小分子化学药物价格昂贵,普及性低。因此,开发价格低廉有效且不良反应小的抗SARS-CoV-2中药具有重要意义。
很多新型冠状病毒感染患者在康复过程中出现了包括低烧、头晕乏力、肺肾阴虚及中气不足等一系列症状[6]。1项荟萃分析表明,中西医结合治疗新型冠状病毒的缓解率和治愈率更高,能减少重症率和住院时间[7]。此外,中国《2019新型冠状病毒感染的肺炎诊疗指南(第八版)》为不同阶段的患者推荐了多种中药,提示中药对新型冠状病毒缓解重症及减少病情恶化具有良好效果[8]。然而中药成分复杂,作用机制难以明确。网络药理学利用药物、化合物、基因和疾病数据库信息构建药物-靶标、靶标-疾病以及药物-疾病相互作用网络,以揭示具有多靶点、多成分特征的中药制剂的复杂机制[9]。
清金益气方由张伯礼院士研发,由6种经典配方加减衍生而成[10],并添加了中药马鞭草,其具有抗氧化、抗炎及抗真菌等特性[11-13]。该方主要由人参、麦冬、五味子、茯苓、半夏、玄参、甘草、柴胡、马鞭草等16味经典药材组成[14],具有益气养阴和清热祛湿等功效。清金益气方在新型冠状病毒感染康复研究中表现出良好的疗效,能明显改善患者的呼吸困难指数和博格疲劳指数[15]。已有案例报道,康复期患者服用清金益气方1 d后能明显缓解低热、头昏、困倦等症状[16]。同时,清金益气方具有良好的安全性,服药期间未发生患者死亡或严重不良反应等事件[15-16]。临床试验相关研究结果证明了清金益气方是1种安全的中草药,可为新型冠状病毒感染恢复期患者带来益处。此外,已有专利发表清金益气方在制备改善气道重塑药物中的应用,提示清金益气方对烟熏联合脂多糖诱导的慢性阻塞性肺疾病有减轻作用[17],但相关的基础研究未见报道。有研究采用超高效液相色谱-四级杆飞行时间质谱法(UPLC-Q-TOF-MS)测定了清金益气方中的化学成分,包括黄酮类、萜类、生物碱及香豆素等成分。并通过肺气虚大鼠模型血浆样品分析药代动力学特征,表明黄芩苷、甘草酸、马鞭草苷、对香豆酸、橙皮苷等多种化合物的代谢产物活性可能在疾病条件下发生改变[10, 18],但其确切的药效物质基础尚未阐明,对SARS-CoV-2感染的体内外研究暂无相关报告,其具体分子机制仍不清楚。因此,本研究对清金益气方抗SARS-CoV-2进行体外药效研究,并基于网络药理学探讨其潜在的作用机制及有效的活性成分,也有助于为其他呼吸系统传染病的治疗提供指导与帮助。
1 材料与方法 1.1 细胞与病毒非洲绿猴肾细胞(Vero E6)以及人肺腺癌细胞(Calu3)购买于美国ATCC细胞保存库。SARS-CoV-2 Omicron BA.1、Omicron BA.5、Omicron XBB变异株由广州医科大学附属第一医院提供。病毒滴度通过观察细胞病变效应(CPE)并采用Reed-Muench法计算半数组织培养感染剂量(TCID50)表示。所有的感染实验均在生物安全3级(BLS-3)实验室(广州海关技术中心P3实验室)进行。
1.2 药物和试剂清金益气方由张伯礼院士团队提供。将清金益气方溶解于二甲亚砜(DMSO)溶液中,调至浓度为100 mg/mL,室温振荡后作为储备液保存于-80 ℃。Paxlovid(上海鸿永生物科技有限公司,批号:262821-202202),使用DMSO溶解,终浓度为100 mg/mL(DMSO的终浓度为0.01%),保存于-80 ℃。TRIzol试剂(美国Thermo Fisher公司);Prime Script TM RT Master Mix试剂盒和SYBR Green qPCR Mixes试剂盒对(南京诺唯赞生物科技有限公司)。
1.3 细胞病变效应(CPE)抑制实验将Vero E6(1×104个/孔)接种于96孔板,于37 ℃含有5% CO2培养箱中培养24 h;实验组和病毒对照组加入100倍TCID50病毒液(SARS-CoV-2 Omicron BA.1、Omicron BA.5、Omicron XBB)100 μL/孔,在37 ℃培养箱孵育2 h。弃掉上清液,加入含清金益气方的稀释后的培养液继续孵育3 d,同时设立细胞对照组和病毒对照组。3 d后光学显微镜下观察细胞状态。与细胞对照组相比,当细胞形态变圆、坏死,从瓶底脱落等现象,判断为细胞病变效应(CPE)。观察所有孔中细胞形态,细胞出现病变程度按以下6级标准记录:无病变出现视为“-”;细胞病变少于10%视为“±”;细胞病变约25%视为“+”;细胞病变约50%视为“+ +”;约75%的细胞出现病变视为“+ + +”;75%以上病变视为“+ + + +”。采用Reed-Muench法计算半数有效浓度(IC50)。判断药效标准:具有50%的抑制病毒CPE的浓度视为有效浓度。
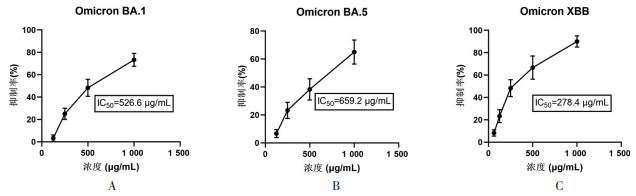
1.4 病毒空斑减少实验实验分为空白组,病毒组,清金益气方高、中、低剂量和Paxlovid组。用100空斑形成单位(PFU)的SARS-CoV-2病毒感染6孔板中的单层Vero E6细胞,在37 ℃下感染2 h;孵育后弃去上清,使用含有1000、500或250 μg/mL清金益气方药液和10 mmol/L Paxlovid的1.5%琼脂覆盖细胞单层;病毒组和空白组加入等量的培养液(1.5%琼脂)。在37 ℃,5% CO2培养箱中孵育48 h,随后使用10%甲醛固定细胞并去除琼脂覆盖层,加入1%结晶紫染色,然后计数斑块并拍照。
1.5 实时荧光定量PCR测定炎症细胞因子的表达在上述药效基础上,选择抑制病毒较强的药物浓度进行实验。将Calu3细胞接种在6孔板,分组为正常组、病毒组、Paxlovid组,以及清金益气方组(500、250、125 μg/mL)。用100空斑形成单位(PFU)的SARS-CoV-2病毒感染6孔板中的单层Calu3细胞,在37 ℃,5% CO2培养箱孵育2 h;2 h后分别加入500、250、125 μg/mL以及10 mmol/L Paxlovid药液,正常组和病毒组分别加入等体积的无血清培养基。24 h后加入TRIzol提取各组细胞的总RNA,其纯度和浓度用超微量紫外可见光分光光度计测定,使用Prime Script TM RT Master Mix试剂盒对RNA进行定量逆转录。然后通过SYBR Green qPCR Mixes试剂盒对cDNA样品进行实时荧光定量聚合酶链反应(RT-qPCR)。RT-qPCR数据由检测系统进行分析。扩增条件为:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 34 s,40个循环。RT-qPCR产物的相对表达量由2-ΔΔCt方法计算[19],以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。通过NCBI数据库进行在线设计引物,并由华大基因公司合成,引物序列见表 1。

|
使用统计分析软件SPSS 25.0对实验数据进行分析,组间比较用单因素方差分析(One-way ANOVA),结果以均数±标准差(x±s)表示,以P<0.05为差异有统计学意义。
1.7 清金益气方治疗新型冠状病毒感染的网络药理学分析筛选清金益气方中人参、麦冬、五味子、苍术、陈皮、甘草、茯苓、清半夏、黄芩、芦根、玄参、淡竹叶、薏苡仁、柴胡、升麻和马鞭草的有效成分和作用靶点信息。在类药性≥0.18、生物利用度≥30%的条件下,通过中药系统药理数据库与分析平台(TCMSP,http://tcmspw.com/index.php)和中药高通量实验与参比数据库(HREB,http://herb.ac.cn/)对清金益气方的有效成分进行检索。然后,通过TCMSP数据库搜索有效成分的靶点,所有靶点信息均通过Uniprot数据库(https://www.uniprot.org/)获得标准化基因名称。
筛选疾病相关基因。使用GeneCards数据库(https://www.genecards.org/)、DrugBank数据库(https://go.drugbank.com/)、TTD数据库(https://db.idrblab.net/ttd/)和CTD数据库(http://ctdbase.org/),设置物种为“Homo sapiens”,以“COVID-19”作为关键词进行检索,合并4个数据库的靶点数据并通过UniProt数据库获得标准化基因名称。然后,使用Venny2.1.0软件(https://bioinfogc.es/tools/venny/)筛选清金益气方治疗新型冠状病毒感染的潜在靶点。
完成蛋白质相互作用(PPI)网络、基因本体(GO)和京都基因组百科全书(KEGG)的分析。通过STRING数据库(https://string-db.org/),将生物物种设为“Homo sapiens”,最小置信度设为0.700,从而构建了潜在的目标PPI网络。利用Cytoscape3.7.2软件(http://www.cytoscape.org/)中的Mcode插件对PPI网络进行可视化。为了研究清金益气方治疗新型冠状病毒感染的可能分子机制,利用在线Metascape平台(http://metascape.org/gp/index.html)进行GO和KEGG富集分析,并将P值阈值设定为小于0.05作为筛选条件。
为了全面了解清金益气方治疗新型冠状病毒感染的分子机制,利用Cytoscape软件构建了“有效成分-枢纽靶点-核心通路”图。
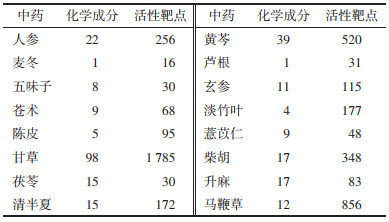
2 实验结果 2.1 清金益气方具有广谱抗SARS-CoV-2的作用为了研究清金益气方对不同亚型的SARS-CoV-2的抑制作用,笔者采用Omicron BA.1、Omicron BA.5、Omicron XBB等3种不同亚型的SARS-CoV-2感染Vero E6细胞,并与不同浓度的清金益气方孵育3 d,通过CPE测定,实验结果显示清金益气方可以抑制Omicron BA.1、Omicron BA.5、Omicron XBB这3种不同亚型SARS-CoV-2的复制,IC50分别为526.6 μg/mL(Omicron BA.1)、659.2 μg/mL(Omicron BA.5)和278.4 μg/mL(Omicron XBB),见图 1。进一步采用病毒空斑减少实验法检测清金益气方抗SARS-CoV-2感染作用,结果同样发现,清金益气方对SARS-CoV-2感染细胞诱导产生细胞空斑形成数量具有明显的抑制作用,同时药物具有剂量依赖性抑制作用(图 2)。CPE抑制实验和病毒空斑减少实验结果提示清金益气方具有广谱抗SARS-CoV-2的作用。
|
| 注:A-C,清金益气方的抑制曲线。 图 1 清金益气方在Vero E6细胞中对新型冠状病毒Omicron BA.1、Omicron BA.5和Omicron XBB的抗病毒活性 Fig. 1 Antiviral activity of Qingjin Yiqi Decoction against Omicron BA.1, Omicron BA.5 and Omicron XBB in Vero E6 cells |
|
| 图 2 清金益气方对SARS-CoV-2病毒空斑减少测定 Fig. 2 Plaque reduction assay of Qingjin Yiqi Decoction against the SARS-CoV-2 |
为了研究清金益气方体外抗SARS-CoV-2感染诱导宿主炎症因子紊乱,笔者构建了体外SARS-CoV-2感染Calu3细胞诱导宿主炎症紊乱模型。通过RT-qPCR检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、干扰素诱导蛋白-10(IP-10)和单核细胞趋化蛋白-1(MCP-1)的信使核糖核酸(mRNA)表达水平。结果表明与空白对照组相比,模型组中IL-6、TNF-α、IP-10和MCP-1的mRNA表达水平明显升高(P<0.001);与模型组相比,清金益气方高、中、低剂量组均能显著降低IL-6、TNF-α和IP-10的mRNA表达水平,高、中剂量组能显著降低MCP-1的mRNA表达水平(图 3)。结果表明,清金益气方能够有效地抑制SARS-CoV-2病毒诱导Calu3细胞产生的炎症反应。
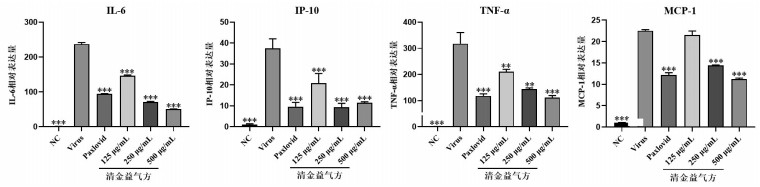
|
| 注:与模型组相比,*P<0.05,*P<0.01,*P<0.001。 图 3 清金益气方降低新型冠状病毒感染Calu3细胞后IL-6、IP-10、TNF-α和MCP-1的mRNA表达水平 Fig. 3 Effects of Qingjin Yiqi Decoction treatment on the mRNA expression levels of inflammatory mediators(IL-6, IP-10, TNF-α and MCP-1)in SARS-CoV-2-infected Calu3 cells |
通过TCMSP和HERB数据库获得了清金益气方的173个有效成分和239个靶点(表 2)。从TCMSP和HREB数据库中共收集获得清金益气方治疗靶点107个,在GeneCards、DrugBank、TTD和CTD数据库中得到新型冠状病毒感染靶点7 748个,通过Venny网站得到清金益气方与新型冠状病毒感染之间存在132个交集核心靶点(图 4)。
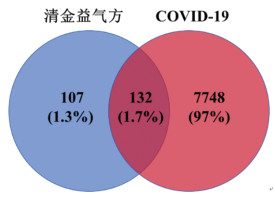
|
| 图 4 清金益气方干预新型冠状病毒感染作用靶点交集图 Fig. 4 Intersection plot of Qingjin Yiqi Decoction against SARS-CoV-2 virus |
利用清金益气方和新型冠状病毒感染的共同潜在靶点绘制了PPI网络,该网络中有132个节点和946条相互作用连线(图 5)。利用Mcode插件对PPI网络进行分析,并得到核心聚类(score ≥ 22.065),结果显示IL-6、TNF、蛋白激酶B(AKT1)、信号传导和转录激活因子3(STAT3)、白介素1β(IL-1β)和转录因子P53(TP53)等靶点是清益气方治疗新型冠状病毒感染的关键靶点。通过中心度的筛选,槲皮素(quercetin)、山柰酚(Kaempferol)、柚皮素(naringenin)、β-谷甾醇(beta-sitosterol)和黄芩素(wogonin)是排名前5位的核心成分。

|
| 图 5 清金益气方治疗新型冠状病毒感染靶点的PPI可视化网格图 Fig. 5 Grid plot of PPI visualization of COVID-19 targets treated with Qingjin Yiqi Decoction |
132个预测靶标的GO注释由3类组成,包括1 706个生物过程术语、161个分子功能术语和98个细胞组分术语。根据Log P值,前6个GO术语被绘制成气泡图(图 6A)。生物过程中的目标基因在细胞对脂质的反应、对激素的反应、对肽的反应、对外源刺激的反应、对细菌来源分子的反应和对脂多糖的反应等方面的富集最为明显,在分子功能中的目标基因在激酶绑定、蛋白激酶结合、蛋白激酶活性、细胞因子活性和激酶调节活性等方面的富集最为明显。通过KEGG通路分析,共得到199个富集结果。根据Log P值,将KEGG中的前35个富集结果绘制成气泡图(图 6B),这些富集结果主要涉及白细胞介素-17(IL-17)信号通路、TNF信号通路、甲型流感、低氧诱导因子-1(HIF-1)信号通路、磷脂酰肌醇-3-激酶-蛋白激酶B(PI3K-Akt)信号通路、Toll样受体信号通路、丝裂原活化蛋白激酶(MAPK)信号通路和冠状病毒病-COVID-19等信号通路。
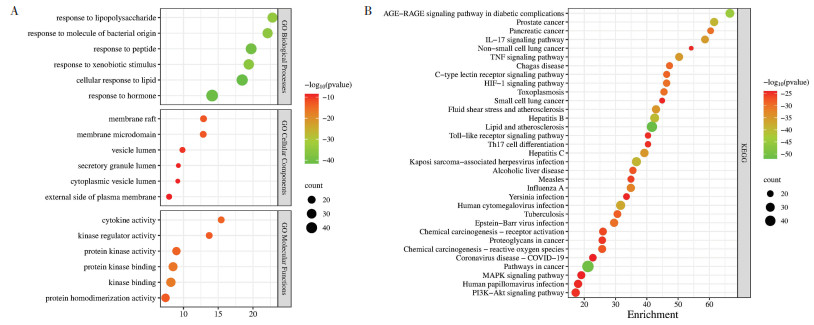
|
| 注:A,GO富集分析(前6个GO术语);B,KEGG通路分析(前21个KEGG术语)。 图 6 清金益气方治疗新型冠状病毒感染潜在靶点的GO富集和KEGG富集分析分析 Fig. 6 Analysis of GO enrichment and KEGG enrichment analysis of potential targets of COVID-19 treated with Qingjin Yiqi Decoction |
利用CytoScape3.7.2软件,通过其中插件“Network analyzer”构建了“有效成分-枢纽靶点-核心通路”网络图。网络图由429个节点和1 334条边组成,包含154种有效成分、242个中心靶点和35条核心通路(图 7)。
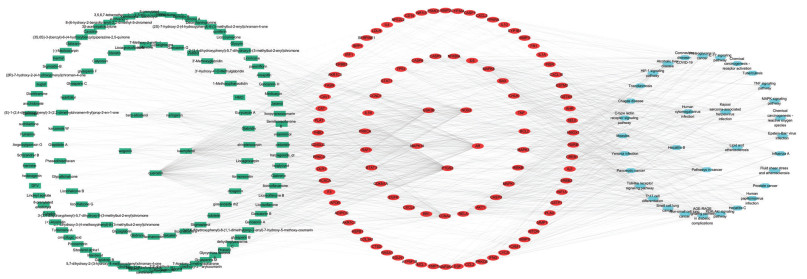
|
| 注:绿色:活性成分;黄色:成分靶点;蓝色:核心通路。 图 7 “活性成分-潜在靶点-信号通路”清金益气方治疗新型冠状病毒感染网络 Fig. 7 Network diagram of "active ingredient-potential target-signaling pathway" of COVID-19 treated with Qingjin Yiqi Decoction |
通过网络药理学分析结果表明,IL-6、TNF、AKT1、STAT3、IL-1β和TP53等靶点是清金益气方治疗新型冠状病毒感染的关键靶点,清金益气方的有效成分可能通过IL-17信号通路、TNF信号通路、甲型流感、HIF-1信号通路、PI3K-Akt信号通路、toll样受体信号通路、MAPK信号通路或冠状病毒病-COVID-19等信号通路治疗新型冠状病毒感染。这些结果表明清金益气方的作用靶点分布于不同的信号通路中,并通过多途径对新型冠状病毒感染起到防治作用。
3 讨论新型冠状病毒感染由于其周期长和传染性强的特点,给社会带来了沉重的经济负担,也给人们带来了更多关于传染病防治的思考,将中医和西医结合防治是做好传染病防控的重要保障之一。中医药在疾病和人类的漫长历史斗争中起了重要作用,也积累了丰富经验。中医理论认为人体靠正气抗病防病,认可“正气存内,邪不可干”的理论。目前的中医主流学术观点认为新型冠状病毒感染属于“湿毒疫”,在恢复期多出现肺脾气虚的症状[20]。曾经的非典型肺炎(以下简称“非典”)在中医学属于温病的范畴,离不开湿、热、毒、疫等因素,在恢复期中容易出现心脾两虚、肺络癥积累、肝经湿热等症状[21]。这些突发呼吸道传染病具有“传染性强、传播速度快和病死率高”的特点,符合中医“瘟疫”范畴。针对新型冠状病毒感染,有着丰富制方布药经验的张伯礼院士在疫情期间,根据武汉、石家庄、天津等多地抗疫康复经验研制了清金益气方。此方是在生脉饮、平胃散、六君子汤、苇茎汤、普济消毒汤和竹叶石膏汤这6种经典方剂基础上加减,具有补气滋阴、健脾和中的作用,能对抗新型冠状病毒感染恢复期病邪。
将中医辨证与西医药理学结合,张伯礼院士在清金益气方中添加了活血解毒药马鞭草,明确其可以有效抑制新型冠状病毒导致的肺损伤,有效治疗小气道炎症,并具有抗微血栓的作用[22]。既往有研究表明马鞭草具有免疫调节、抗炎、抗病毒等作用,其防治新型冠状病毒感染的作用可能与其增强机体免疫功能、降低炎症细胞因子水平、抗肺纤维化及抑制病毒核酸复制等密切相关[23]。方中所含黄酮类、多酚、多糖等物质的人参、甘草、黄芩具有抗氧化,抗炎及增强免疫等作用[24-26],有助于促进新型冠状病毒感染恢复期患者早日康复。由此推断,清金益气方可能通过多组分、多靶点和多途径发挥抗新型冠状病毒、促进患者恢复等作用。
在抗击新型冠状病毒感染疫情的过程中,中医药通过临床筛选出多种推荐用药,如连花清瘟胶囊、化湿败毒方等。这些方剂主要用于新型冠状病毒感染治疗期,证候适应证各异,对新型冠状病毒有一定的作用,能明显改善临床症状。与连花清瘟胶囊、化湿败毒方等抗新型冠状病毒感染中药不同,清金益气方被推荐用于新型冠状病毒感染康复期。清金益气方在抗新型冠状病毒的同时具有解热、抗炎等作用,对病毒及病毒引起的病理反应能多靶点、多途径发挥作用,还能增强机体免疫功能,有效改善患者疲劳及呼吸困难症状,促进新型冠状病毒感染恢复期患者早日康复[23-26]。
多数用于新型冠状病毒感染防治的小分子化学药疗效明确,但可能出现明显的副作用,如Paxlovid可能会引起胃肠系统不适,Azvudine有血糖升高或粒细胞降低等风险[4-5]。与西药不同,中药在抗病毒时并非只针对某一病毒,它体现整体观念,协调各脏器组织器官的功能。清金益气方治疗新型冠状病毒感染康复期患者临床研究中,未出现严重不良反应,未观察到明显肝肾功能异常[15-16]。中药主要依靠调节免疫反应、减少炎症抵抗病毒感染以及保护和修复器官。中药治疗病毒性感染疾病具有毒副作用较小的优势,使得中药在疾病的预防、治疗及康复阶段都能发挥其作用[27]。尽管中医药在防治病毒性感染疾病的疗效和科学价值已在世界范围内得到认可,但仍有一些问题尚未解决。由于成分的复杂性和现有技术的限制,这些中成药和中药方剂的作用机制尚未被完全了解,需要更多的实验研究来阐明中药的作用机制。新型冠状病毒感染大流行虽然已经过去,研究清金益气方的抗病毒作用对未来应对新发突发呼吸系统传染病仍有重要意义。
清金益气方为新型冠状病毒感染康复患者提供了良好的疗效,然而清金益气方的成分非常复杂,阐明其治疗新型冠状病毒感染的潜在活性成分和明确的药理机制仍然是个难题。在本研究中,笔者首先进行了体外抗病毒和抗炎药效实验,以阐明清金益气方对新型冠状病毒感染具有抗病毒及抗炎的作用。前期有研究表明,清金益气颗粒在治疗SARS-CoV-2感染患者恢复期的低热方面具有良好效果,曾被推荐为新型冠状病毒感染恢复期康复用药[16]。但是清金益气方是否可以抑制SARS-CoV-2尚无相关研究。体外实验结果表明,清金益气方在Vero E6细胞上可以明显抑制新型冠状病毒SARS-CoV-2 Omicron BA.1、Omicron BA.5和Omicron XBB的复制,并能抑制SARS-CoV-2病毒空斑的形成,其中高浓度的剂量组与阳性药组效果相当。由此初步可以判断清金益气方具有广谱抗SARS-CoV-2的作用。炎症风暴因子普遍存在于重症感染患者中,研究发现在SARS-CoV-2的感染者血清中IL-6、IL-8和TNF-α等炎症因子表达升高[28],从而引发过度炎症反应,导致急性肺损伤甚至急性呼吸窘迫综合征,这可能是SARS-CoV-2感染肺炎患者病情加重或者死亡的主要原因。同时,越来越多证据表明中药可以通过调节细胞炎症因子水平从而发挥抗炎作用[29]。结合本次体外实验,清金益气方的干预使SAS-CoV-2感染的Calu3细胞的IL-6、IP-10、TNF-α及MCP-1的mRNA水平显著降低,推测清金益气方中的某些成分可能是通过抑制炎症因子进而抑制炎症风暴起抗新型冠状病毒感染的作用。有研究学者运用超高效液相色谱分析清金益气方的成分有黄岑素、芒柄花素、人参皂苷、甘草素、柚皮素、芍药苷、槲皮素、汉黄岑素、五味子素、哈巴苷、当归酰基戈米辛等[10, 18]。结合这些成分,笔者通过网络药理学分析筛选出清金益气方治疗新型冠状病毒感染的主要活性物质有槲皮素(quercetin)、山柰酚(Kaempferol)、柚皮素(naringenin)、β-谷甾醇(beta-sitosterol)和黄岑素(wogonin)等,它们影响新型冠状病毒感染相关的靶点。其中槲皮素、山柰酚和柚皮素等是典型的黄酮类物质,具有多种药理活性,如抗炎和免疫抑制、抗氧化、抗菌类及抗癌等[30-32]。既往有研究报道,槲皮素可以通过MAPK信号通路体外抑制IL-6和MCP-1等mRNA水平起抗炎作用[33];山柰酚可能通过MAPK或Akt信号传导抑制IL-6、IL-8和COX-2等表达从而发挥抗炎作用[34];黄岑素具有抗病毒、抗炎及抗肿瘤活性[35];柚皮素已被证明可以对抗炎症细胞因子,是IL-6和肿瘤坏死因子的理想靶点[36]。由此推测,其中的槲皮素、山柰酚、黄岑素和柚皮素等成分值得重点关注,它们可能是清金益气方发挥抗病毒、调节肺部急性炎症及抗新型冠状病毒感染作用的关键物质基础。
PPI网格图排序靠前的核心靶点,即IL-6、TNF、AKT1、STAT3、IL-1β和TP53,可能是清金益气方对治疗目的疾病的核心靶点。结合笔者构建的体外新型冠状病毒感染Calu3细胞诱导宿主炎症紊乱模型结果,清金益气方可以有效抑制IL-6和TNF-α等炎症因子水平,与筛选出来的核心靶点部分重合。结合既往研究,IL-6在新型冠状病毒感染的病理过程中具有重要作用,表现为新型冠状病毒感染患者血清的IL-6水平升高,随病情好转后IL-6水平下降[28]。新型冠状病毒感染患者有明显的中性粒细胞增加及淋巴细胞减少,在重症新型冠状病毒感染患者中出现促炎细胞因子如TNF-α与IL-8等升高的现象[28]。由此推测新型冠状病毒感染病程发展阶段涉及免疫反应,调节免疫有望成为治疗新型冠状病毒感染的重要方向。除了IL-6和TNF-α外,清金益气方还能降低新型冠状病毒感染引起的MCP-1和IP-10的mRNA升高,而TNF-α刺激MCP-1的表达与Akt通路密切相关[37],STAT3通路被激活时趋化因子IP-10可升高[38]。既往研究及本次研究都表明AKT1、STAT3等是治疗新型冠状病毒感染的关键靶标,与炎症转化等过程密切相关[39-40]。由此提示,清金益气方治疗新型冠状病毒感染的抗炎机制很可能与IL-6、TNF、AKT1和STAT3等关键靶标关系最密切。
通过GO富集分析可见,生物学过程中主要在对外来化合物的反应、激素分泌、激素转运等方面具有突出作用。同时,KEGG富集通路分析发现,清金益气方的抗病毒和抗炎机制与IL-17、TNF信号通路、甲型流感、PI3K-Akt信号通路、Toll样受体信号通路、MAPK信号通路或冠状病毒病-COVID-19信号通路等相关。其中,筛选多条通路与核心靶点有关,与体外实验结果相对应。如PI3K-Akt、MAPK信号通路与核心靶点IL-6相关,TNF信号通路与核心靶点TNF相关,PI3K-Akt信号通路与核心靶点AKT1相关。除此以外,IL-17也是一种重要的促炎因子,它能诱导多种细胞合成分泌免疫和炎症因子,其信号通路可激活MAPK途径中的趋化因子和抗细胞因子,从而使机体的免疫应答反应受到影响[41],但是本文未对IL-17进行相关研究,清金益气方能否通过IL-17信号通路发挥抗新型冠状病毒感染的关键作用有待实验验证。以上进一步说明了清金益气方治疗新型冠状病毒感染的通路较多,机制较复杂。
综上所述,本研究结果提示清金益气方对防治新型冠状病毒感染的作用机制可能与槲皮素、山柰酚、黄芩素及柚皮素等黄酮类有效成分结合核心靶点(IL-6、TNF、STAT3和AKT1等),从而调控炎症和病毒相关的TNF信号通路、PI3K-Akt信号通路及MAPK信号通路和生物学过程。当然,清金益气方的新成分和新靶点仍需深入挖掘,还迫切需要进一步广泛的基础研究及临床试验,开展药理实验验证核心靶点和关键通路,才能进一步确认清金益气方的疗效及潜在的机制,以期更好指导临床应用。
| [1] |
REN W L, ZHANG Y, RAO J H, et al. Evolution of immune evasion and host range expansion by the SARS-CoV-2 B.1.1.529(Omicron) variant[J]. mBio, 2023, 14(2): e0041623. DOI:10.1128/mbio.00416-23 |
| [2] |
FAN Y, LI X, ZHANG L, et al. SARS-CoV-2 Omicron variant: Recent progress and future perspectives[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 141. DOI:10.1038/s41392-022-00997-x |
| [3] |
DIJOKAITE-GURALIUC A, DAS R, NUTALAI R, et al. Antigenic characterization of SARS-CoV-2 Omicron subvariant BA.4.6[J]. Cell Discovery, 2022, 8(1): 127. DOI:10.1038/s41421-022-00493-0 |
| [4] |
PESKO B, DENG A, CHAN J D, et al. Safety and tolerability of paxlovid(nirmatrelvir/ritonavir) in high-risk patients[J]. Clinical Infectious Diseases, 2022, 75(11): 2049-2050. DOI:10.1093/cid/ciac588 |
| [5] |
YANG H, WANG Z J, JIANG C G, et al. Oral azvudine for mild-to-moderate COVID-19 in high risk, nonhospitalized adults: Results of a real-world study[J]. Journal of Medical Virology, 2023, 95(7): e28947. DOI:10.1002/jmv.28947 |
| [6] |
ZHAO Y M, SHI L, JIANG Z D, et al. The phenotype and prediction of long-term physical, mental and cognitive COVID-19 sequelae 20 months after recovery, a community-based cohort study in China[J]. Molecular Psychiatry, 2023, 28(4): 1793-1801. DOI:10.1038/s41380-023-01951-1 |
| [7] |
LIU M, GAO Y, YUAN Y, et al. Efficacy and safety of integrated traditional Chinese and Western medicine for corona virus disease 2019(COVID-19): A systematic review and meta-analysis[J]. Pharmacological Research, 2020, 158: 104896. DOI:10.1016/j.phrs.2020.104896 |
| [8] |
HEALTH CHINA N. National guidelines for diagnosis and treatment of pancreatic cancer 2022 in China[J]. Chinese Journal of Cancer Research, 2022, 34(3): 238-255. DOI:10.21147/j.issn.1000-9604.2022.03.05 |
| [9] |
HOPKINS A L. Network pharmacology: The next paradigm in drug discovery[J]. Nature Chemical Biology, 2008, 4(11): 682-690. DOI:10.1038/nchembio.118 |
| [10] |
LI G T, WANG X R, LUO L F, et al. Identification of chemical constituents of Qingjin Yiqi Granules and comparative study on pharmacokinetics of 23 main bioactive components in normal and Lung-Qi deficiency rats by UPLC-MS/MS method[J]. Journal of Chromatography B, 2023, 1226: 123802. DOI:10.1016/j.jchromb.2023.123802 |
| [11] |
CALVO M I. Anti-inflammatory and analgesic activity of the topical preparation of Verbena officinalis L[J]. Journal of Ethnopharmacology, 2006, 107(3): 380-382. DOI:10.1016/j.jep.2006.03.037 |
| [12] |
REHECHO S, HIDALGO O, GARCÍA-IÑIGUEZ DE CIRANO M, et al. Chemical composition, mineral content and antioxidant activity of Verbena officinalis L[J]. Food Science and Technology, 2011, 44(4): 875-882. |
| [13] |
CASANOVA E, GARCÍA-MINA J M, CALVO M I. Antioxidant and antifungal activity of Verbena officinalis L. leaves[J]. Plant Foods for Human Nutrition, 2008, 63(3): 93-97. DOI:10.1007/s11130-008-0073-0 |
| [14] |
YANG X H, WANG S Q, QI L N, et al. An efficient method for qualitation and quantitation of multi-components of the herbal medicine Qingjin Yiqi Granules[J]. Journal of Pharmaceutical and Biomedical Analysis, 2023, 227: 115288. DOI:10.1016/j.jpba.2023.115288 |
| [15] |
PANG W T, YANG F W, ZHAO Y B, et al. Qingjin Yiqi Granules for post-COVID-19 condition: A randomized clinical trial[J]. Journal of Evidence-Based Medicine, 2022, 15(1): 30-38. DOI:10.1111/jebm.12465 |
| [16] |
田盈, 张硕, 郑文科, 等. 清金益气颗粒治疗新型冠状病毒奥密克戎变种毒株感染者恢复期低热验案1则[J]. 天津中医药, 2022, 39(6): 692-696. |
| [17] |
张晗, 陈璐, 王彧, 等. 清金益气方在制备改善气道重塑药物中的应用: CN116531472A[P]. 2023-08-04.
|
| [18] |
YANG X H, CHEN S J, DU K Z, et al. Simultaneous determination of multiple components in rat plasma by UHPLC-sMRM for pharmacokinetic studies after oral administration of Qingjin Yiqi Granules[J]. Frontiers in Pharmacology, 2023, 14: 1155973. DOI:10.3389/fphar.2023.1155973 |
| [19] |
PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45 |
| [20] |
郑文科, 张俊华, 杨丰文, 等. 从湿毒疫论治新型冠状病毒肺炎[J]. 中医杂志, 2020, 61(12): 1024-1028. |
| [21] |
谷晓红, 于河, 司庆阳. 传染性非典型肺炎中医学研究状况分析[J]. 北京中医药大学学报, 2005, 28(5): 83-85. DOI:10.3321/j.issn:1006-2157.2005.05.027 |
| [22] |
熊可, 杨丰文, 黄明. 大医之魂: 张伯礼对抗疫及中医现代化的突出贡献[J]. 环球中医药, 2021, 14(12): 2109-2112. |
| [23] |
张向丽, 吕开原, 张静泽, 等. 基于文献探讨马鞭草对新型冠状病毒肺炎的作用机制[J]. 武警后勤学院学报(医学版), 2020, 29(7): 68-74. |
| [24] |
杨珊, 赵暖暖, 杨鑫, 等. 人参活性成分及药理作用研究进展[J]. 中医药导报, 2023, 29(1): 105-107, 116. |
| [25] |
郭宇. 中药黄芩的化学成分及药理作用的分析[J]. 临床医药文献电子杂志, 2019, 6(63): 137. |
| [26] |
KAO T C, WU C H, YEN G C. Bioactivity and potential health benefits of licorice[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 542-553. DOI:10.1021/jf404939f |
| [27] |
HUANG M, LIU Y Y, XIONG K, et al. The role and advantage of traditional Chinese medicine in the prevention and treatment of COVID-19[J]. Journal of Integrative Medicine, 2023, 21(5): 407-412. DOI:10.1016/j.joim.2023.08.003 |
| [28] |
HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. The Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [29] |
CALIXTO J B, CAMPOS M M, OTUKI M F, et al. Anti-inflammatory compounds of plant origin. Part Ⅱ. modulation of pro-inflammatory cytokines, chemokines and adhesion molecules[J]. Planta Medica, 2004, 70(2): 93-103. DOI:10.1055/s-2004-815483 |
| [30] |
YANG D Y, WANG T C, LONG M, et al. Quercetin: Its main pharmacological activity and potential application in clinical medicine[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 8825387. |
| [31] |
LIAO W Z, CHEN L Y, MA X, et al. Protective effects of kaempferol against reactive oxygen species-induced hemolysis and its antiproliferative activity on human cancer cells[J]. European Journal of Medicinal Chemistry, 2016, 114: 24-32. DOI:10.1016/j.ejmech.2016.02.045 |
| [32] |
JIN L T, ZENG W F, ZHANG F Y, et al. Naringenin ameliorates acute inflammation by regulating intracellular cytokine degradation[J]. Journal of Immunology, 2017, 199(10): 3466-3477. DOI:10.4049/jimmunol.1602016 |
| [33] |
CHENG S C, HUANG W C, S PANG J H, et al. Quercetin inhibits the production of IL-1β-induced inflammatory cytokines and chemokines in ARPE-19 cells via the MAPK and NF-κB signaling pathways[J]. International Journal of Molecular Sciences, 2019, 20(12): 2957. DOI:10.3390/ijms20122957 |
| [34] |
LIAN J J, CHENG B F, GAO Y X, et al. Protective effect of kaempferol, a flavonoid widely present in varieties of edible plants, on IL-1β-induced inflammatory response via inhibiting MAPK, Akt, and NF-κB signalling in SW982 cells[J]. Journal of Functional Foods, 2016, 27: 214-222. DOI:10.1016/j.jff.2016.09.003 |
| [35] |
BANIK K, KHATOON E, HARSHA C, et al. Wogonin and its analogs for the prevention and treatment of cancer: A systematic review[J]. Phytotherapy Research, 2022, 36(5): 1854-1883. DOI:10.1002/ptr.7386 |
| [36] |
AMELIMOJARAD M, AMELIMOJARAD M. Interleukin-6 inhibitory effect of natural product naringenin compared to a synthesised monoclonal antibody against life-threatening COVID-19[J]. Reviews in Medical Virology, 2023, 33(4): e2445. DOI:10.1002/rmv.2445 |
| [37] |
MURAO K, OHYAMA T, IMACHI H, et al. TNF-alpha stimulation of MCP-1 expression is mediated by the Akt/PKB signal transduction pathway in vascular endothelial cells[J]. Biochemical and Biophysical Research Communications, 2000, 276(2): 791-796. DOI:10.1006/bbrc.2000.3497 |
| [38] |
XU W, JOO H, CLAYTON S, et al. Macrophages induce differentiation of plasma cells through CXCL10/IP-10[J]. Journal of Experimental Medicine, 2012, 209(10): 1813-1823,S1-2. DOI:10.1084/jem.20112142 |
| [39] |
APPELBERG S, GUPTA S, SVENSSON AKUSJÄRVI S, et al. Dysregulation in Akt/mTOR/HIF-1 signaling identified by proteo-transcriptomics of SARS-CoV-2 infected cells[J]. Emerging Microbes & Infections, 2020, 9(1): 1748-1760. |
| [40] |
GAJJELA B K, ZHOU M M. Calming the cytokine storm of COVID-19 through inhibition of JAK2/STAT3 signaling[J]. Drug Discovery Today, 2022, 27(2): 390-400. DOI:10.1016/j.drudis.2021.10.016 |
| [41] |
HUANG Y F, BAI C, HE F, et al. Review on the potential action mechanisms of Chinese medicines in treating Coronavirus Disease 2019(COVID-19)[J]. Pharmacological Research, 2020, 158: 104939. DOI:10.1016/j.phrs.2020.104939 |
2. State Key Laboratory of Respiratory Disease, National Clinical Research Center for Respiratory Disease, Guangzhou Institute of Respiratory Health, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou 511436, China;
3. Eighth School of Clinical Medicine, Guangzhou University of Traditional Chinese Medicine, Foshan 528051, China
 2024, Vol. 41
2024, Vol. 41