文章信息
- 刘含之, 王浩, 潘彦舒, 周满元, 方琪, 孙婧妍
- LIU Hanzhi, WANG Hao, PAN Yanshu, ZHOU Manyuan, FANG Qi, SUN Jingyan
- 基于脑脊液冲刷规律探讨枣仁安神颗粒对大鼠睡眠作用机制研究
- Research on the mechanism of sedative effect of Zaoren Anshen Granules on the sleep of rats based on the analysis of cerebrospinal fluid flushing patterns
- 天津中医药大学学报, 2024, 43(10): 907-914
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(10): 907-914
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.10.07
-
文章历史
收稿日期: 2024-07-07
睡眠对于维持大脑功能具有至关重要的作用。通过睡眠可以恢复机体正常功能,帮助大脑清除白天积累的促眠物质和多种有毒的中枢神经系统代谢废物[1]。脑脊液主要由脉络丛分泌产生,但并不完全由脉络丛分泌,脑间质液、室管膜和毛细血管也可能在脑脊液分泌中发挥作用。人的平均脑脊液体积约为150 mL,成人脑脊液的总分泌量为每日400~600 mL。脑脊液24 h内更新约4次。脑脊液循环是一种动态现象。脑脊液产生的大部分过程发生在脑室,被动吸收发生在整个蛛网膜下腔的大脑和脊髓部分[2]。脑脊液的整体流动是由其生产部位的压力高于其吸收部位的压力驱动的[3]。在衰老过程中,脑脊液周转率下降导致大脑和脑脊液中积累有害的分解代谢物,在某些神经退行性疾病中也能够观察到这些分解代谢物。脑脊液的循环冲刷可以对中枢神经系统起到缓冲保护作用,并为脑细胞提供营养,参与调节神经元功能,清除脑组织代谢产物,冲刷大脑积累的毒性物质,在维持脑组织内稳态、保证大脑功能正常运行方面发挥了重要作用。在睡眠或麻醉药物模拟睡眠期间,脑脊液与脑间质液的交换增强,脑间质液含量大约增加60%[4]。在神经活动的慢波阶段,脑脊液的周期性冲刷在巩固记忆功能方面发挥关键作用[5]。因此,睡眠会影响脑脊液流动,脑脊液在慢波睡眠期间的周期性冲刷作用可能是大脑清除有毒代谢产物的途径。近年来,失眠问题日益普遍,传统中药枣仁安神颗粒因其改善睡眠的显著效果而受到关注。枣仁安神颗粒是由炒酸枣仁、丹参、醋五味子3味中药制得的中药复方制剂[6],具有养血安神、补心养肝功效[7],主要用于治疗心肝血不足引起的失眠、健忘、头晕、头痛及神经衰弱等[8]。研究证实该方可以增强γ-氨基丁酸A型受体(GABAA)功能,提高五羟色胺神经元活性[9],发挥抗焦虑和改善睡眠作用[10]。越来越多的研究表明,脑脊液的分泌和冲刷作用与睡眠结构密切相关,但目前尚无枣仁安神颗粒对脑脊液分泌和冲刷的相关研究。因此,本研究旨在探讨枣仁安神颗粒通过影响脑脊液分泌和冲刷作用从而改善大鼠睡眠结构的作用机制,以期为通过改善睡眠结构来治疗睡眠障碍甚至其他脑液稳态失衡相关脑病提供新的治疗思路。
1 实验材料 1.1 实验动物SPF级雄性SD大鼠44只,7周龄,体质量(280±20)g,由斯贝福(北京)生物技术有限公司提供,动物使用许可证号为SCXK(京)2019-0010。饲养于中国科学院生物物理研究所SPF级动物房。温度(24.0±0.5)℃,相对湿度50%~60%,12 h/12 h明暗交替,自由饮水摄食,适应性喂养7 d。本研究经中国科学院生物物理研究所伦理委员会审批(编号:SYXK2023164)。
1.2 药物及制备枣仁安神颗粒由炒酸枣仁、丹参、醋五味子组成,购自台州南峰药业有限公司,批号:221023,规格:5 g/包。颗粒剂为药材加水煎煮后,将滤液浓缩后的清膏加上适量糊精,混匀干燥后得到。将颗粒用蒸馏水完全溶解制成混悬液,每只大鼠每日给药量为874 mg/kg。戊巴比妥购自Sigma公司,批号:P3761,用生理盐水配制成0.3%浓度溶液。水合氯醛购自国药集团化学试剂有限公司,批号:20211103,用生理盐水配制成10%浓度溶液。
1.3 试剂与仪器二喹啉甲酸(BCA)蛋白浓度测定试剂盒(索莱宝,货号:PC0020),大鼠水通道蛋白1(AQP1)酶联免疫吸附(ELISA)定量检测试剂盒(睿信生物,货号:RX30774),大鼠钠离子(Na+)-钾离子(K+)-氯离子(Cl-)协同转运蛋白1(NKCC1)ELISA试剂盒(睿信生物,货号:RX301473R),彩虹180广谱蛋白标志物(Marker)(11-180 KD)50T(索莱宝,货号:PR1910),甲醇(麦克林生化科技,货号:C15967592),AQP1抗体(Proteintech中国公司,货号:BC022486),NKCC1抗体(Proteintech中国公司,货号:BC033003),内参抗体(Bioss,货号:Bs-0061R),二抗羊抗兔(Immuno Way,货号:RS0002),二抗羊抗鼠(北京标牌生物科技有限公司,货号:#Z1117),发光液A液(北京庄盟国际生物基因有限公司,货号:ZD310),发光液B液(北京庄盟国际生物基因有限公司,货号:ZD310)。
脑立体定位仪(深圳市瑞沃德生命科技有限公司,型号:68000),颅钻(深圳市瑞沃德生命科技有限公司,型号:78001),电子天平(赛多利斯科学仪器有限公司,型号:SQP),无线遥感监测系统(北京软隆生物技术有限公司,型号:Softron 2000),植入子(北京软隆生物技术有限公司,型号:Softron DSCF-08),核磁共振设备(德国布鲁克公司,型号:BRUER BioSpec 117/16 USR),兽用制氧机(深圳市瑞沃德生命科技有限公司,型号:ROC-5A),低温高速离心机(Eppendorf Himac Technologies Co. Ltd.,型号:CF16RN),组织研磨仪(Retsch,型号:MM400),组合式全温振荡摇床(上海知楚仪器有限公司,型号:ZQTY-8F8),酶标仪(MOLECULAR DEVICES,型号:Spectra Max i3x),热盖金属浴(杭州米欧仪器有限公司,型号:DHC-100H),小型垂直电泳槽(伯乐,型号:552BR 201811),快速半干转系统(伯乐,型号:690BR 027825),化学发光成像分析仪(GE Healthcare Bio-Sciences AB,型号:Amersham Imager 600)。
2 实验方法 2.1 分组及给药雄性SD大鼠44只,随机分为正常组与枣仁安神颗粒组,每组22只。枣仁安神颗粒组:根据人与动物非标准体质量动物的校正系数表等效剂量换算,枣仁安神颗粒组大鼠连续给予枣仁安神颗粒874 mg/kg水溶液8 d,每日8∶00给药。正常组给予等量纯净水作为对照。
2.2 指标检测 2.2.1 一般状况在监控视频下观察并记录干预前后大鼠精神状态、活动度、皮毛色泽等情况。
2.2.2 无线脑电(EEG)、肌电(EMG)植入手术实验麻醉选用两种麻醉药物:盐酸氯胺酮注射液、戊巴比妥钠。先腹腔注射盐酸氯胺酮(0.1 mL/kg),等待10 min。当大鼠四肢无力不能站立行走后,再腹腔注射0.3%戊巴比妥钠(10 mL/kg)。戊巴比妥钠现配现用。观察大鼠角膜反射和掐尾疼痛反射是否消失。待大鼠完全麻醉后,进行腹部和头部手术部位备皮。备皮后在手术局部注射少量盐酸利多卡因。腹部切口沿腹中线切开,长度约1.5 cm,分层剥离腹膜、肌肉。分开后在腹腔内置入植入子。将头皮切开,在头部正中位置剪去一块长约1 cm、宽约0.4 cm的头皮组织。使用刀片和棉签刮去暴露出部位的骨膜和结缔组织,用3%的双氧水冲洗,再用生理盐水冲洗并吸干。充分暴露头骨。电灼出血部位止血。植入的金属丝经皮下到达颅骨外部。以大鼠的Bregma点为原点,定位4个坐标:(1.5 mm,1.5 mm)、(-2 mm,1.5 mm)、(-1 mm,-1.5 mm)、(2 mm,-3 mm),在颅骨上钻4个小孔。钻孔深度应以在不损伤硬脑膜的前提下钻透颅骨为宜。再将4个颅钉分别放入钻好的孔中并拧紧,确保其与硬脑膜不接触或接触但不刺穿硬脑膜。自制导管将EEG导线引至颅骨暴露处,EMG导线沿皮下引至斜方肌处,调整适宜长度后打结。混合好牙科水泥,涂抹至颅骨上。缝合切口,在伤口处涂抹红霉素软膏。术后将大鼠置于保温毯上或盖上垫料,注意保暖。以能采集到EEG、EMG信号为手术成功。
正常组大鼠昼夜连续监测72 h;枣仁安神颗粒组给予枣仁安神颗粒水溶液,连续8 d,在给药第6至8天将大鼠送入机器昼夜连续监测。导出数据,转换格式后使用可以阅读EDF格式的专业软件打开,EEG信号滤波范围设为0.5~40 Hz,EMG信号滤波范围设为10~200 Hz。标记觉醒期、非快眼动睡眠期(NREM)、快眼动睡眠期(REM)。
2.2.3 中脑导水管中段脑脊液流速测定大鼠在进入超高场强核磁共振设备检测前先进行睡眠诱导准备。实验选择10%水合氯醛腹腔注射作为睡眠诱导剂,用于诱导NREM。注射后观察大鼠睡眠诱导状态10 min,掐尾和角膜反射消失后可以送入核磁共振监测睡眠。上机后的前50 min先进行序列调试,正式连续测定中脑导水管中段脑脊液60 min。
先运行预扫描序列,成功后以定位序列设定参数:回声时间1.8 ms,相位电影成像时间60 ms,平均次数2次,扫描次数1次,翻转角20 °,编码方向由矢状面从左至右扫描全脑。
随后全脑结构的扫描使用结构相序列。结构相序列的参数设定:回声时间30 ms,相位电影成像时间57 ms,平均次数2次,扫描次数1次,编码方向由冠状面从上端至下端扫描全脑。
得到全脑结构图后,继续以多层定位序列定位中脑导水管矢状面,设定参数:回声时间3 ms,相位电影成像时间15 ms,平均次数3次,扫描次数1次,翻转角8 °,编码方向由矢状面从左至右扫描全脑。
通过多层定位与序列定位,在冠状面和矢状面交叉定位中脑导水管最佳层面于中脑导水管的中段[11],使用血流图序列对中脑导水管中段垂直于脑脊液流动方向进行横断面连续成像[12],设定参数为回声时间4.2 ms,相位电影成像时间15 ms,平均次数6次,扫描次数1次,翻转角15 °,编码方向从头端至足端。从头端至足端流动时其速度为正值,向头端流动时为负值,扫描周期为52 s。扫描在水合氯醛诱导的睡眠状态下完成,总扫描时间大约60 min。核磁共振扫描图像后在ParaVision® 360 V1.1软件中进行处理。在中脑导水管中心区域勾画出感兴趣区面积[13],分析得出中脑导水管中部中心区域的流速,单位为cm/s。
2.2.4 ELISA法检测给药结束后,取大鼠大脑前额叶皮质进行AQP1、NKCC1检测。用预冷的磷酸缓冲盐溶液(PBS)冲洗组织,称取质量后将组织剪碎,加入对应体积的PBS。预冷处理组织研磨仪,研磨5 min,离心15 min(5 000 r/min,离心半径10 cm),ELISA法检测上清液AQP1、NKCC1含量,按照试剂盒说明书操作。
2.2.5 Western Blot法检测给药结束后,取大鼠大脑前额叶皮质,提取组织总蛋白,用BCA蛋白定量试剂盒检测蛋白浓度,加入上样缓冲液,煮沸变性。蛋白样品采用10%凝胶电泳分离,快速半干转仪将蛋白转移至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h,1×TBST洗5次,每次5 min,分别加入AQP1一抗(1∶3 000)、NKCC1一抗(1∶3 000)、β-Actin一抗(1∶5 000)。4 ℃孵育过夜,1×TBST洗5次,每次5 min,孵育二抗,AQP1、NKCC1加入抗兔二抗(1∶10 000),β-Actin加入抗鼠二抗(1∶10 000),室温孵育1 h,加入显影液采用化学发光成像分析仪曝光,用ImageJ软件进行灰度分析,以β-Actin为内参,计算目的蛋白的相对表达量。
2.3 统计学方法采用SPSS 25.0统计软件进行分析,在数据处理过程中进行正态分布检验和方差齐性检验,计量资料以均数±标准差(x±s)表示,两组独立样本比较采用独立样本t检验,自身对照的重复实验采用重复测量设计。P < 0.05表示差异具有统计学意义。
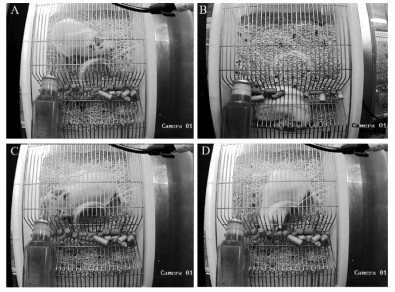
3 结果 3.1 枣仁安神颗粒对大鼠一般状况的影响所有大鼠皮毛整洁,色泽光亮,行动自如,一般情况良好。见图 1。
|
| 注:A,活跃状态;B,睡眠状态;C,饮水状态;D,进食状态。 图 1 大鼠屏蔽箱内活动情况 |
观察活动规律可以发现大鼠是夜行性动物,睡眠多在白天,夜间活动活跃;睡眠姿势为蜷卧,头朝向内侧,符合动物的睡眠特点;睡眠结构呈多相性睡眠,睡眠周期短的有几分钟,长则几十分钟,24 h内反复多次睡眠。
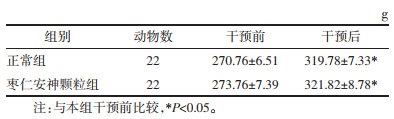
与正常组比较,枣仁安神颗粒组大鼠在干预前后的体质量未见明显变化,差异无统计学意义(P>0.05)。与干预前比较,正常组和枣仁安神颗粒组大鼠体质量增加(P < 0.05)。见表 1。
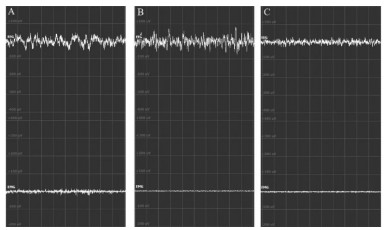
正常大鼠连续昼夜监测的EEG、EMG图像见图 2。觉醒期的EEG图像呈高频率,低振幅活动;EMG图像呈高频率电活动信号,提示肌肉收缩。睡眠期的EEG图像呈高、低振幅交替发生为慢波睡眠NREM;低振幅的连续快波为快波睡眠REM。
|
| 注:A,觉醒期;B,NREM;C,REM。 图 2 大鼠觉醒期、NREM、REM的EEG与EMG图像 |
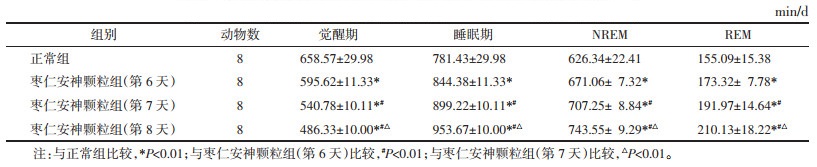
EEG结果显示,与正常组比较,枣仁安神颗粒组大鼠第6、7、8天的大鼠觉醒期时间缩短,睡眠时间增加,NREM、REM时间增加,差异有统计学意义(P < 0.01)。枣仁安神颗粒组大鼠第6、7、8天之间的觉醒时间逐日减少,睡眠时间逐日增加,NREM、REM时间逐日增加,差异有统计学意义(P < 0.01)。见表 2。
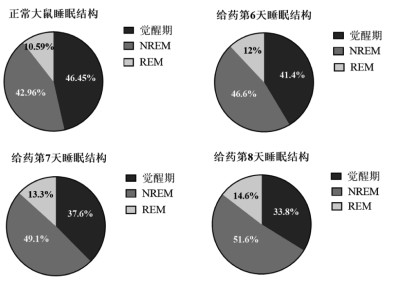
大鼠连续昼夜的睡眠结构监测结果显示,大鼠每天的觉醒期约占全天的46.45%,NREM约占全天的42.96%,REM约占全天的10.59%。服用枣仁安神颗粒后大鼠觉醒期占比减少,NREM、REM占比增加。见图 3。
|
| 图 3 枣仁安神颗粒对正常大鼠睡眠结构的影响(n=8) |
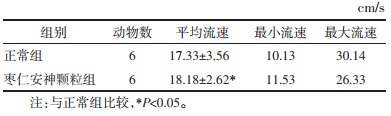
核磁共振结果显示,脑脊液流速变化呈现一定规律性,在NREM脑脊液呈节律性冲刷,见图 4。与正常组比较,枣仁安神颗粒组的脑脊液流速加快,差异有统计学意义(P < 0.05)。见表 3。
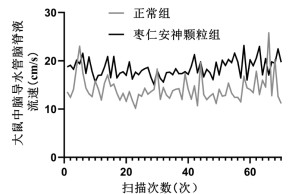
|
| 图 4 大鼠中脑导水管中段脑脊液流速变化图 |
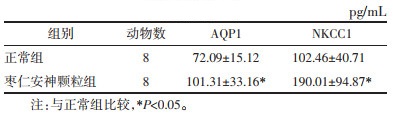
与正常组比较,枣仁安神颗粒组大脑前额叶皮质AQP1、NKCC1含量增加,差异有统计学意义(P < 0.05)。见表 4。
与正常组比较,枣仁安神颗粒组大脑前额叶皮质AQP1、NKCC1蛋白表达水平增加,差异有统计学意义(P < 0.05)。见图 5、表 5。
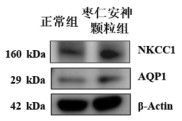
|
| 图 5 两组大鼠大脑前额叶皮质AQP1、NKCC1的蛋白表达条带图 |
高质量的睡眠是保障人体生理功能正常运行、正常参与社会活动的重要基础,与情绪、记忆等密切相关。新的研究表明,睡眠期间脑脊液冲刷较觉醒期流速加快,帮助大脑清除觉醒期间积累的代谢废物,有助于恢复精力与记忆力等[5]。
脑脊液主要由脉络丛分泌,存在于脑室、脊髓蛛网膜下腔中。最新研究表明,由侧脑室脉络丛和第三、四脑室脉络丛产生的脑脊液占脑脊液分泌总量的60%~75%。另外,研究认为脑间质液、室管膜和毛细血管也可能与脑脊液的分泌有关,但仅约占脑脊液分泌总量的25%。由此可见,脉络丛仍是脑脊液分泌的主要来源[14]。AQP1在脉络丛上皮细胞朝向脑室的顶膜中[15],它广泛存在于人体肾、脉络丛、肛门、胆囊、肝脏等组织,其中脉络丛是人体组织AQP1表达最丰富的部位[16],它是环磷酸腺苷(cGMP)门控阳离子通道[17],在脉络丛中发挥水通道与门控离子通道的双重作用[18],积极参与脑脊液的分泌过程[19]。NKCC1蛋白及参与调节的激酶是参与调节脑脊液分泌的重要蛋白,是控制脑脊液分泌的重要药理学靶标[20],其在脉络丛上皮细胞的向外特殊定向运输离子的能力与脑脊液分泌相关。作为协同转运蛋白的一种,NKCC1具有普遍协同转运蛋白特性,在转运离子的同时还可以携带水,每个运输周期可以携带300~500个水分子[21],因此在脑脊液的分泌中发挥重要作用。
通过分析枣仁安神颗粒的现代药理学成分和临床疗效,研究人员认为枣仁安神颗粒具有改善睡眠功效。方中重用酸枣仁,其性平,味甘,可入心、肝经,具有宁心安神、益阴敛汗功效,主要有效成分为酸枣仁皂苷、斯皮诺素等物质。酸枣仁皂苷是GABAA受体激动剂,可以增强GABAA受体功能[22];斯皮诺素是黄酮类成分,作用于五羟色胺能神经系统,可以显著增加戊巴比妥钠诱导的睡眠潜伏期时长,延长睡眠时间,发挥镇静催眠作用,达到改善睡眠的目的[23]。丹参归心、肝经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效,其化学成分主要为丹参酮型二萜与酚酸[24]。其中丹参酮ⅡA具有抗氧化、抗炎作用,通过激活大麻素受体1(CNR1)/磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信号通路,拮抗海马细胞凋亡,减轻海马神经元萎缩性损失,调节睡眠、学习、记忆功能,发挥脑保护作用[25]。五味子味酸、甘,性温,入肺经,具有补肾宁心、益气生津、收敛固涩功效,其有效成分木脂素是发挥镇静、催眠作用的主要有效成分,主要作用于觉醒系统,作用机制可能与降低觉醒相关核团蛋白表达及神经元兴奋性,减少中缝核5羟色胺神经元异常放电频率有关[26]。五味子醇甲可以通过调节单胺类神经递质,缩短觉醒期,增加睡眠期[27]。综上所述,枣仁安神颗粒在改善睡眠方面确有良效。
本研究系统性地探索了枣仁安神颗粒对正常大鼠睡眠的改善作用和脑脊液分泌、冲刷的作用机制,对大鼠进行了睡眠-觉醒活动的脑电监测、药物诱导睡眠状态下的核磁共振监测、脑组织蛋白表达情况相关研究。结果显示,枣仁安神颗粒组的大鼠全天NREM、REM时间占比增加,觉醒期时间占比下降,提示枣仁安神颗粒具有改善大鼠睡眠结构的作用,能够延长睡眠时间。在模拟睡眠的麻醉药物诱导下进行核磁共振中脑导水管中段的脑脊液流速监测,结果发现枣仁安神颗粒组大鼠脑脊液的流速加快且稳定,提示枣仁安神颗粒延长睡眠的作用机制可能与调节脑脊液的冲刷作用、加快脑脊液流速有关。从参与脑脊液分泌的相关蛋白着手,分析AQP1和NKCC1在脑内的表达情况,发现枣仁安神颗粒组大鼠脑内AQP1和NKCC1表达水平均升高,说明枣仁安神颗粒可能通过影响脑脊液分泌蛋白起到改善睡眠的作用。综合上述结果推测枣仁安神颗粒可以延长睡眠时间,其作用机制可能与影响脑脊液的生成与分泌相关蛋白AQP1、NKCC1的表达有关。实验为枣仁安神颗粒延长睡眠的作用机制提供了新的证据,为通过改善睡眠来治疗睡眠障碍甚至是其他脑液稳态失衡相关脑病提供了新的治疗思路,后续将引入睡眠障碍相关疾病,进一步探讨睡眠与脑脊液冲刷之间的关系。
本实验的创新点:1)实验创新性地改善了无线脑电植入方法。区别于传统有线脑电技术,无线脑电技术是一种灵活的无线遥感监测记录器,能够通过无线发射植入子、信号传导系统、信号过滤-放大系统、数模转换器等装置,将电信号转换成数字信号。无线发射植入子信号经过两级放大和模数/数模转换,将结果输送至配套计算机设备,然后借助sbp-2019软件进行采集与记录EEG、EMG信号。配套的屏蔽箱可以有效保证动物处于舒适的温度、湿度环境,屏蔽周围噪音、静电等干扰,定时照明装置12 h明暗交替1次,内有监控录像,适合开展大鼠脑电研究,对动物活动限制小,解决了有线脑电连接及拆除电缆的复杂程序,丰富了研究内容,提供了一种实用的解决方案,扩大了当前行为神经科学领域可能的测量范围,适合开展睡眠等生理活动相关研究。
2)实验在检测中脑导水管流速时使用超高场强核磁共振设备。该设备磁场强度达到11.7 Tesla,磁体孔径宽度为16 cm,场均匀性为±4 ppm。该系统采用了零液氦蒸发和无液氮技术,可以减少维护成本并延长维护间隔,还配备了超屏蔽制冷超导磁体,增强了其在无液氮情况下的运行能力。高梯度强度、快速切换速率、全二阶和Z3高功率匀场通道、核磁共振成像冷探头等,显著提高了灵敏度和信号检测的准确性,得到的图像分辨率高,帮助研究人员获得了更加真实可靠的实验数据。
虽然本研究取得了一些有意义的发现,但仍然存在一些局限性。如实验对象仅为大鼠,其结果是否能够完全应用于人类仍需要进一步验证。此外,虽然本研究发现枣仁安神颗粒可能影响AQP1和NKCC1的表达,但其具体分子机制仍然需要深入研究。综上所述,本研究为理解枣仁安神颗粒改善睡眠的作用及其与脑脊液分泌、冲刷机制的关联提供了重要线索。未来的研究可以进一步探索这些机制的详细过程,以期为睡眠障碍和其他脑液稳态失衡相关脑病的治疗提供新的有效方法。
致谢 感谢中国科学院生物物理研究所脑与认知科学国家重点实验室赵旭东老师、左真涛老师对本实验的帮助与支持,在本实验的研究中,贵平台的无线遥感监测系统和超高场强核磁共振设备的支持至关重要。
| [1] |
王莎, 龙春梅, 龚紫薇, 等. 睡眠对大脑清除代谢产物的影响: 基于类淋巴系统的思考[J]. 中华神经科杂志, 2023, 56(1): 101-105. |
| [2] |
庞大承, 潘彦舒. 脑脊液生成、循环代谢及睡眠状态下冲刷作用的研究进展[J]. 广西医学, 2023, 45(4): 477-480. |
| [3] |
GREITZ D, GREITZ T, HINDMARSH T. A new view on the CSF-circulation with the potential for pharmacological treatment of childhood hydrocephalus[J]. Acta Paediatrica, 1997, 86(2): 125-132. DOI:10.1111/j.1651-2227.1997.tb08850.x |
| [4] |
XIE L L, KANG H Y, XU Q W, et al. Sleep drives metabolite clearance from the adult brain[J]. Science, 2013, 342(6156): 373-377. DOI:10.1126/science.1241224 |
| [5] |
FULTZ N E, BONMASSAR G, SETSOMPOP K, et al. Coupled electrophysiological, hemodynamic, and cerebrospinal fluid oscillations in human sleep[J]. Science, 2019, 348(6465): 628-631. |
| [6] |
张颖, 吴怡, 齐越, 等. 枣仁安神颗粒改善睡眠作用的机制[J]. 中成药, 2016, 38(10): 2268-2270. |
| [7] |
王浩, 潘彦舒, 刘含之, 等. 基于无线遥感监测系统观察枣仁安神颗粒对正常SD大鼠睡眠—觉醒规律的作用研究[J]. 环球中医药, 2023, 16(12): 2408-2413. DOI:10.3969/j.issn.1674-1749.2023.12.002 |
| [8] |
解满江, 屠鹏飞, 张庆英. 枣仁安神成方制剂的研究进展[J]. 中国中药杂志, 2021, 46(6): 1301-1326. |
| [9] |
温子帅, 李新蕊, 木盼盼, 等. 酸枣仁中斯皮诺素、酸枣仁皂苷A含量测定及其质量等级划分标准研究[J]. 中国药房, 2019, 30(20): 2802-2807. |
| [10] |
王文凯. 生、炒酸枣仁相伍抗抑郁作用机制及相伍后化学成分变化研究[D]. 哈尔滨: 黑龙江中医药大学, 2014.
|
| [11] |
FEINBERG D A, MARK A S. Human brain motion and cerebrospinal fluid circulation demonstrated with MR velocity imaging[J]. Radiology, 1987, 163(3): 793-799. DOI:10.1148/radiology.163.3.3575734 |
| [12] |
LINNINGER A A, XENOS M, ZHU D C, et al. Cerebrospinal fluid flow in the normal and hydrocephalic human brain[J]. IEEE Transactions on Biomedical Engineering, 2007, 54(2): 291-302. DOI:10.1109/TBME.2006.886853 |
| [13] |
蒋雨芸. 相位对比法MRI在流体模型中的实验研究[D]. 昆明: 昆明医科大学, 2022.
|
| [14] |
HLADKY S B, BARRAND M A. Fluid and ion transfer across the blood-brain and blood-cerebrospinal fluid barriers: a comparative account of mechanisms and roles[J]. Fluids and Barriers of the CNS, 2016, 13(1): 19. DOI:10.1186/s12987-016-0040-3 |
| [15] |
NIELSEN S, SMITH B L, CHRISTENSEN E I, et al. Distribution of the aquaporin CHIP in secretory and resorptive epithelia and capillary endothelia[J]. Proceedings of the National Academy of Sciences, 1993, 90(15): 7275-7279. DOI:10.1073/pnas.90.15.7275 |
| [16] |
MOBASHERI A, MARPLES D. Expression of the AQP-1 water channel in normal human tissues: a semiquantitative study using tissue microarray technology[J]. American Journal of Physiology-Cell Physiology, 2004, 286(3): C529-C537. DOI:10.1152/ajpcell.00408.2003 |
| [17] |
BOASSA D, YOOL A J. A fascinating tail: cGMP activation of aquaporin-1 ion channels[J]. Trends in Pharmacological Sciences, 2002, 23(12): 558-562. DOI:10.1016/S0165-6147(02)02112-0 |
| [18] |
BOASSA D, STAMER W D, YOOL A J. Ion channel function of aquaporin-1 natively expressed in choroid plexus[J]. Journal of Neuroscience, 2006, 26(30): 7811-7819. DOI:10.1523/JNEUROSCI.0525-06.2006 |
| [19] |
VERKMAN A S, TRADTRANTIP L, SMITH A J, et al. Aquaporin water channels and hydrocephalus[J]. Pediatric Neurosurgery, 2017, 52(6): 409-416. DOI:10.1159/000452168 |
| [20] |
ZHANG J W, KARIMY J K, DELPIRE E, et al. Pharmacological targeting of SPAK kinase in disorders of impaired epithelial transport[J]. Expert Opinion on Therapeutic Targets, 2017, 21(8): 795-804. DOI:10.1080/14728222.2017.1351949 |
| [21] |
MACAULAY N, ZEUTHEN T. Water transport between CNS compartments: contributions of aquaporins and cotransporters[J]. Neuroscience, 2010, 168(4): 941-956. DOI:10.1016/j.neuroscience.2009.09.016 |
| [22] |
张艳慧, 付萍萍, 汪安, 等. 酸枣仁中掺理枣仁的高效液相色谱法鉴别方法研究[J]. 安徽医药, 2024, 28(3): 482-485. |
| [23] |
范兰兰. 基于"生熟异治"质量标志物的生、炒酸枣仁质量控制研究[D]. 合肥: 安徽中医药大学, 2021.
|
| [24] |
万新焕, 王瑜亮, 周长征, 等. 丹参化学成分及其药理作用研究进展[J]. 中草药, 2020, 51(3): 788-798. |
| [25] |
张媛, 毛浩萍, 樊官伟. 丹参酮ⅡA药理作用研究进展[J]. 天津中医药大学学报, 2019, 38(1): 15-19. |
| [26] |
李玟玟. 基于觉醒水平探讨五味子木脂素改善睡眠剥夺大鼠的睡眠作用[D]. 哈尔滨: 黑龙江中医药大学, 2023.
|
| [27] |
邢楠楠, 屈怀东, 任伟超, 等. 五味子主要化学成分及现代药理作用研究进展[J]. 中国实验方剂学杂志, 2021, 27(15): 210-218. |
 2024, Vol. 43
2024, Vol. 43