文章信息
- 张少辉, 李思媛, 温梦昕, 李亮
- ZHANG Shaohui, LI Siyuan, WEN Mengxin, LI Liang
- 扶正固表方对免疫低下小鼠免疫功能的实验研究
- Experimental study of Fuzheng Gubiao Decoction on immune function of immunocompromised mice
- 天津中医药大学学报, 2024, 43(6): 531-537
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(6): 531-537
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.06.10
-
文章历史
收稿日期: 2024-03-06
免疫系统是人体重要的防御保护屏障,在抵御外邪入侵、维持内外环境稳定方面具有重要的作用,其主要由固有免疫和获得性免疫组成,通过非特异性免疫和体液免疫、细胞免疫等途径御邪外出,保护机体健康[1]。当机体免疫受损或低下时,无力与外来邪气抗争,导致机体阴阳失调,易诱发多种疾病,其中有95%的疾病发生与之相关[2]。
中医源远流长,早在《黄帝内经》中就有相关记载,即“邪之所凑,其气必虚”[3],中医认为邪气最易乘虚而入侵犯机体,邪盛正衰,促使疾病的发生发展,治疗主要从增强人体正气、改善正邪力量对比、祛除邪气入手[4],即中医“治未病”理论,而扶正固本作为中医“治未病”的重要手段,旨在通过增强机体的正气,实现“治未病”,在疾病的预防和治疗中具有重要意义。随着现代科学不断进步,药理研究表明中药含有的多种活性成分能够调节机体免疫防治疾病[5],而众多临床实践也证实中药组方制剂对扶助机体正气,调节免疫系统效果较好[6],其以效应多样性、双向调节、毒副作用相对较小等特点也越来越受到广泛关注。
扶正固表方由黄芪、白术、防风、金银花、连翘组成,具有扶助机体正气,提升免疫力、抑制炎症进展、促进抗体形成等功能。现代研究表明黄芪主要活性成分为黄芪多糖,在调节机体免疫细胞改善免疫抑制状态、增强机体的免疫应答能力,抑制炎症反应等方面具有明显作用[7];白术含有倍半萜、内酯类、挥发油等成分,能影响机体多种细胞因子水平,调控淋巴细胞转化增殖,刺激Th2应答[8],改善免疫抑制状态,提高免疫力[9];防风主要化学成分有挥发油类、色原酮类和香豆素类等物质,能够促进机体免疫系统特异性免疫和非特异性免疫功能[10],从而提升免疫力;金银花含有有机酸类、黄酮类以及皂苷类等物质,能起到促进脾淋巴细胞增殖等体内免疫增强的作用[11];连翘主要成分有木质素类、黄酮类、萜类及挥发油及苷类,能调控机体免疫细胞和免疫细胞因子,具有显著免疫调节作用[12]。研究通过观察扶正固表方对免疫低下小鼠免疫功能的影响,以期为临床实践提供实验依据。
1 材料与方法 1.1 实验动物SPF级Balb/c雄性小鼠,4~6周,体质量(18±2)g,购于湖南斯莱克景达实验动物有限公司,使用许可证号:SYXK(湘)2019-0004。于湖南中医药大学实验动物中心饲养,温度22~26 ℃,湿度40%~70%,可自由饮水,每日定量喂食。本实验经湖南中医药大学实验动物伦理委员会审批通过,伦理编号:LLBH-202305300002。
1.2 药物与试剂扶正固表方中药饮片(批号221101)购于九芝堂药房;盐酸左旋咪唑片(仁和堂药业,批号210902);环磷酰胺(阿拉丁试剂有限公司,批号A2203037);CD4+-PE、CD8+-PE荧光抗体(批号AF11402,AF11486)、小鼠白介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)酶联免疫吸附法(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号AK00688H3175,GY068V663518,KL00LBND1330);苏木精-伊红(HE)染色试剂盒(北京索莱宝科技股份有限公司,批号G1120);荧光定量逆转录和染料试剂盒(苏州近岸科技股份有限公司,批号05276806,05304312);NF-κB p65、IκBα抗体(成都正能生物技术有限公司,批号M08NO7P,M31JL89)。
1.3 主要仪器电子天平(上海梅特勒-托利多仪器有限公司,型号:ME204);高速冷冻离心机(湖南湘仪有限公司,型号TGL-16);酶标仪(美国Thermo Fisher公司,型号Varioskan LUX);流式细胞仪(美国BD公司,型号Fortessa);全自动封闭式生物组织脱水机(孝感耀楚医疗器械科技有限公司,型号YT-12K);石蜡切片机(型号39507)、半自动轮转式切片机(型号38355)购于意大利Diapath公司;光学显微镜(厦门麦克奥迪光学仪器有限公司,型号BA410E/B)荧光定量PCR仪(瑞士Roche公司,LightCycler 480Ⅱ);核酸蛋白表达成像系统(美国BIO-RAD公司,型号BIO-RAD ChemiDoc XRS+)。
1.4 模型制备及分组干预48只Balb/c小鼠适应性喂养7 d后随机分为对照组、模型组、扶正固表方组和西药组,每组12只。除对照组外,其他各组小鼠按照75 mg/kg腹腔注射环磷酰胺,每两天1次,连续3次[13];对照组同步腹腔注射等体积0.9% NaCl溶液。造模成功后开始给药,根据《中医科研设计与统计学》,实验动物与人体表面积换算治疗剂量[14],70 kg成人每日服用55 g生药剂量换算,得出扶正固表方组和西药组分别按照7.15 g/kg、30 mg/kg[15]进行药物干预,连续灌胃7 d,对照组和模型组给予等量生理盐水灌胃。每天定期观察动物的一般状态以评判模型,注射后小鼠逐渐出现体质量减轻、活动减少、反应迟钝、蜷缩弓背、毛发疏松暗淡,喜抱团,食量减少等[16]免疫力低下的体征;胸腺指数和脾脏指数降低;血清中IL-4、IFN-γ水平降低,TNF-α的水平升高这些结果表明免疫低下小鼠模型建立成功[17-18]。因实验造模及动物取材中造成部分动物损耗,故指标的样本量不尽相同。
1.5 指标检测 1.5.1 一般状态评价在药物干预前后观察并记录各组小鼠的宏观体征和行为学变化。
1.5.2 体质量监测实验期间每天记录各组小鼠的体质量,并观察其变化。
1.5.3 器官指数摘取小鼠的脾脏和胸腺观察其大小,电子天平称质量计算各组小鼠的脾脏指数和胸腺指数,计算公式为:脾脏或胸腺质量(mg)/体质量(g)。
1.5.4 血清细胞因子检测小鼠禁食24 h后眼球取血,并离心取血清。按照ELISA试剂盒操作步骤检测小鼠血清中IL-4、IFN-γ、TNF-α的表达水平。
1.5.5 脾脏病理形态学观察取新鲜脾脏于4%多聚甲醛中固定24 h后进行脱水和石蜡包埋处理,切片后用苏木精和伊红染色,显微镜下观察组织损伤情况。
1.5.6 脾脏T淋巴细胞亚群分析取小鼠新鲜脾脏研磨成细胞悬液,显微镜下计数后洗涤细胞,磷酸盐缓冲液(PBS)重悬细胞,加入CD4+、CD8+对应的荧光抗体进行组合染色,冰上避光孵育,PBS重悬后过滤网,通过流式细胞仪进行淋巴细胞测定。
1.5.7 脾组织NF-κB p65和IκBα mRNA表达采用实时荧光定量聚合酶链反应法(RT-PCR)检测各组脾脏组织的NF-κB p65和IκBα mRNA相对表达量。取新鲜脾脏组织加入RNA抽提试剂(TRIZOL)室温裂解10 min,加入氯仿振荡30 s,室温孵育2 min,4 ℃ 12 000 rpm,离心半径11 cm,离心20 min,取适量上清加入适量异丙醇后静置,再次离心弃上清;加入适量无水乙醇弃上清,室温干燥,使用分光光度计进行RNA质量检测,选取质量过关的样品进行逆转录并进行qRT-PCR实验,实验结束后采集数据并根据2-ΔΔCt方法进行数据统计分析。
1.5.8 脾组织NF-κB p65和IκBα蛋白表达通过蛋白抽提试剂盒提取脾组织蛋白,制备5%浓缩胶和12%分离胶,100 V、1 h电泳完转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶封闭2 h。一抗1∶1 000过夜,二抗1∶10 000室温1 h,以GAPDH为内参。滴加化学发光显影液后通过Image软件成像。
1.6 数据处理与分析数据采用GraphPad Prism 9.5.0软件进行统计分析。各组数据以均数±标准差(x±s)表示,均符合正态分布和方差齐性,采用单因素方差分析进行多组间比较,以P<0.05为差异有统计学意义。
2 结果 2.1 小鼠的一般状况对照组小鼠状态良好,活动自如,毛发光亮;模型组精神萎靡,毛发黯淡,行动迟缓,抱团喜卧。扶正固表方组和西药组在给药1周后一般情况较模型组均有所改善。
2.2 各组小鼠的体质量变化实验期间各组小鼠的体质量变化如表 1,图 1。如图所示,与对照组相比,模型组小鼠在环磷酰胺建模后5 d体质量明显下降,表明造模效果较好;而扶正固表方组和西药组在药物干预后体质量均逐步上升,趋于正常;西药组体质量上升较扶正固表方组明显。
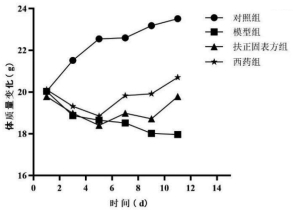
|
| 图 1 各组小鼠体质量变化 |
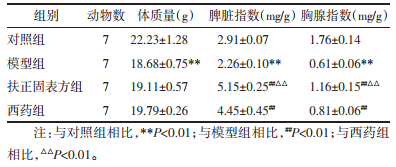
如表 1,与对照组相比,模型组的脾脏指数和胸腺指数均下降,差异具有统计学意义(P < 0.01),说明环磷酰胺诱导的免疫低下模型较成功;与模型组相比,扶正固表方组和西药组在药物干预后均有不同程度回升,差异具有统计学意义(P < 0.01),说明扶正固表方和西药干预对环磷酰胺导致的小鼠免疫器官损伤有一定改善作用;与西药组相比,扶正固表方组对免疫低下小鼠的脾脏和胸腺修复作用明显,差异具有统计学意义(P < 0.01)。
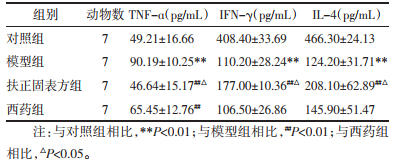
2.4 各组小鼠血清细胞因子含量变化如表 2所示,与对照组相比,模型组小鼠血清中TNF-α水平升高(P < 0.01),而IL-4、IFN-γ水平降低(P < 0.01),差异均具有统计学意义。与模型组相比,扶正固表方组和西药组的TNF-α水平降低(P < 0.01),其中扶正固表方组IL-4、IFN-γ水平均提升(P < 0.01),差异均具有统计学意义;而西药组的变化不明显(P > 0.05)。与西药组相比,扶正固表方组的TNF-α降低(P < 0.05),IL-4、IFN-γ水平升高(P < 0.05),差异均具有统计学意义。
脾组织HE染色结果如图 2所示。对照组脾组织红髓与白髓分界清晰,生发中心较为明显,红髓相间分布于白髓和脾小梁之中;与对照组相比,模型组红髓与白髓界限不清,伴有红细胞渗出和淋巴细胞浸润;与模型组相比,扶正固表方组和西药组白髓与红髓分界逐渐清晰,红细胞渗出减少,其中扶正固表方组改善较为明显。
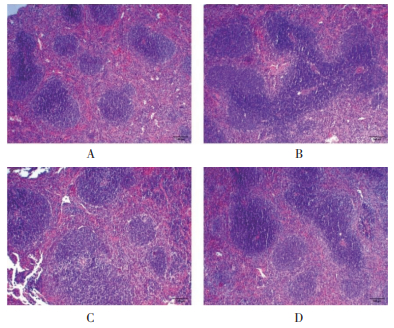
|
| 注:A,对照组;B,模型组;C,扶正固表方组;D,西药组。 图 2 各组小鼠脾脏病理形态学改变(100×,bar =100 μm) |
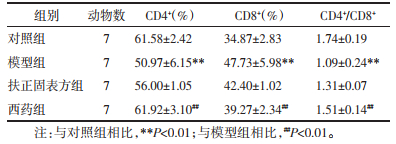
如图 3、表 3,与对照组相比,模型组小鼠脾淋巴细胞CD4+细胞数、CD4+/CD8+比例降低(P < 0.01),而CD8+细胞占比升高(P < 0.01),差异均具有统计学意义;与模型组相比,西药组CD4+、CD4+/CD8+细胞比例升高(P < 0.01),CD8+细胞比例降低(P < 0.01),差异均具有统计学意义,扶正固表方组虽然效果不及西药组,但能较大程度提升小鼠脾淋巴细胞亚群CD4+、CD4+/CD8+比例,降低CD8+细胞占比。
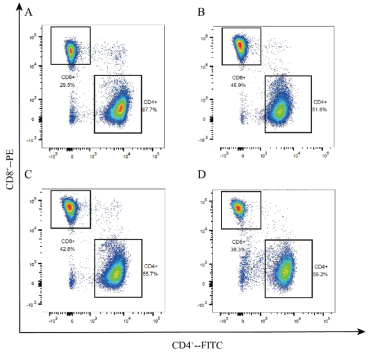
|
| 注:A,对照组;B,模型组;C,扶正固表方组;D,西药组。 图 3 各组小鼠流式图 |
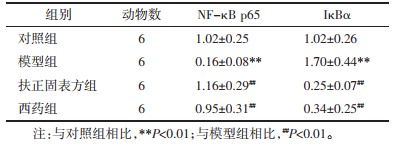
如表 4,与对照组相比,模型组小鼠脾组织中NF-κB p65 mRNA相对表达水平降低(P < 0.01),而IκBα表达升高(P < 0.01),差异均具有统计学意义;与模型组相比,扶正固表方组和西药组NF-κB p65相对表达均有提升(P < 0.01),IκBα相对表达降低(P < 0.01),差异均具有统计学意义。
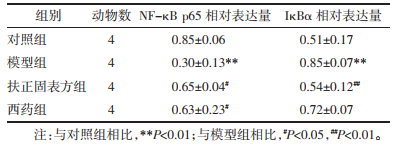
如图 4,表 5。与对照组相比,模型组小鼠脾组织NF-κB p65蛋白相对表达水平降低(P < 0.01),而IκBα表达升高(P < 0.01),差异均具有统计学意义;与模型组相比,扶正固表方组和西药组NF-κB p65相对表达均有提升(P < 0.05),扶正固表方组IκBα相对表达降低(P < 0.01),差异均具有统计学意义;而西药组IκBα表达无统计学意义(P > 0.05)。
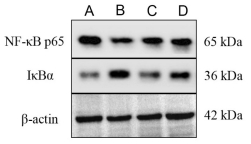
|
| 注:A,对照组;B,模型组;C,扶正固表方组;D,西药组。 图 4 各组小鼠脾组织NF-κB p65、IκBα蛋白表达情况 |
中医认为疾病的发生与进展取决于机体邪正的盛衰,以正气强弱为主导,贯穿于疾病始终。正气是人体抵御病邪、自我修复的能力或功能,即人体免疫器官、组织等形成的一种保护机制,而邪气则是指导致机体免疫失衡的致病因素[19],现代研究认为能够正向调节免疫的细胞及细胞因子,如自然杀伤细胞、细胞毒性CD8+ T淋巴细胞、TNF-α等属于正气范畴;而肿瘤细胞、免疫抑制型细胞因子,如IL-10等,则归属于邪气范畴[20]。《黄帝内经》中指出“正气存内,邪不可干”“邪之所凑,其气必虚”,当机体正气强盛,与邪气抗争的能力较强,能够抵抗病原微生物入侵[21],维护人体正常健康状态和机体功能;而当机体正气不足或虚弱时,邪气乘虚而入,气血阴阳失调,从而导致疾病的产生。中医药是长期临床实践积累的宝贵财富,在提高机体免疫力、恢复机体平衡方面具有明显的优势。
扶正固表方是基于中医“扶正祛邪”治疗原则组方形成,除顾护正气外,亦重视祛除邪气。方中黄芪甘温,益气固表,为君药;白术健脾益气,助黄芪益气固表,使气旺表实,为臣药;防风祛风走表以增黄芪益气御邪之功,固表不留邪,祛邪不伤正;伍以连翘、金银花辛凉透邪,清热解毒。诸药相合共奏益气固表透邪之效。
环磷酰胺是一种烷化类免疫抑制剂,能杀死免疫细胞,影响机体的体液免疫和细胞免疫起到免疫抑制作用[22];建立小鼠免疫抑制模型效果良好[23-24]。本实验通过腹腔注射环磷酰胺后模型小鼠均出现精神萎靡、嗜睡喜卧、行动迟缓、毛发黯淡的体征,而给药干预后上述症状减轻。脾脏是T、B淋巴细胞免疫应答的主要场所,而胸腺是T淋巴细胞分化成熟的场所,因此免疫器官指数能够作为反映机体免疫功能的指标之一[25],实验通过测定各组小鼠的脾脏指数和胸腺指数发现,模型组小鼠脾脏指数和胸腺指数均出现下降(P < 0.01),表明模型较为成功,而药物干预组的免疫器官指数均有提升(P < 0.01),其中扶正固表方组提升较为明显,可能与其刺激免疫系统导致功能亢进相关。
IL-4、IFN-γ和TNF-α是机体细胞免疫因子,其中IL-4是一种介导T、B细胞免疫反应的抗炎因子,能促进淋巴细胞增殖和抗体产生;IFN-γ可促进Th1细胞增殖与分化,提高NK细胞和吞噬细胞活性[26];TNF-α是机体免疫炎性因子,在调节细胞免疫平衡和分化方面具有重要作用[27]。相关研究[28]表明当其含量异常时会导致免疫因子紊乱,免疫功能出现异常。ELISA结果显示,与对照组相比,模型组血清IL-4、IFN-γ含量均降低(P < 0.01),TNF-α含量升高(P < 0.01);与模型组相比,药物干预组IL-4、IFN-γ及TNF-α水平均有改善;T淋巴细胞是参与机体免疫应答的重要免疫细胞,CD4+和CD8+细胞作为T淋巴细胞的不同分型亚群,可用于评估细胞免疫状态,而CD4+/CD8+比例对调节免疫细胞功能具有重要作用。当机体免疫低下时,可表现为CD4+细胞数降低,CD8+细胞比例升高,CD4+/CD8+比值下降甚则倒置[29],流式细胞术结果显示,与对照组相比,模型组的CD4+细胞数与CD4+/CD8+比例均降低(P < 0.01),CD8+细胞数升高(P < 0.01),药物干预组均较模型组有所改善。说明扶正固表方可能通过调节机体的免疫细胞因子水平和T淋巴细胞亚群比例来提升机体免疫力。
NF-κB是1种调节免疫反应、细胞存活相关基因表达的核转录因子,正常情况下和IκBα形成无活性复合体存在于胞浆中,当受到外界刺激时,IκBα被磷酸化并发生降解,使得NF-κB(p65)与之解离并进入细胞核中激活多种细胞因子转录[30]。研究表明当NF-κB/IκBα通路对调节免疫反应具有重要作用,能参与细胞免疫和体液免疫,并促进IL-4、IFN-γ等细胞因子的分泌,导致机体炎症和免疫防御[31],这与本实验的血清ELISA结果一致。RT-PCR及免疫蛋白印迹法结果表明,与对照组相比,模型组脾组织中NF-κB p65 mRNA与蛋白表达显著下降、而IκBα mRNA水平升高(P < 0.01),扶正固表方和西药干预后均能提升脾组织NF-κB的表达,降低IκBα表达,提示扶正固表方可能从激活NF-κB/IκBα通路增强机体免疫力。
综上所述,通过环磷酰胺制备免疫低下小鼠模型评价确切,且研究结果初步表明扶正固表方可对环磷酰胺导致的免疫低下小鼠有一定的免疫调节作用,但其具体作用机制仍待深入研究。
| [1] |
肖丹, 唐宇, 何清湖, 等. 龟甲胶对不同年龄不同性别免疫低下型大鼠的调节作用研究[J]. 时珍国医国药, 2022, 33(6): 1322-1325. |
| [2] |
李成荣. 自身免疫性疾病免疫发病机制概况[J]. 中国实用儿科杂志, 2010, 25(5): 411-414. |
| [3] |
迟华基. 评热病进退论正邪消长: 《素问·评热病论》[J]. 山东中医杂志, 1985, 4(1): 55-57, 54. |
| [4] |
许荣忠, 李雁. 试论中医药治疗肿瘤中扶正祛邪与免疫的关系[J]. 辽宁中医杂志, 2018, 45(9): 1858-1859. |
| [5] |
杨菊, 范治国. 中药对机体免疫功能的调节作用[J]. 中国药业, 2021, 30(22): 125-127. |
| [6] |
张丹丹, 韩汶润, 朱彦, 等. 中药调控免疫系统治疗动脉粥样硬化研究进展[J]. 中国药理学与毒理学杂志, 2021, 35(12): 937-948. |
| [7] |
沈冠男, 宛传奇, 杨扬, 等. 黄芪多糖作为疫苗佐剂的免疫活性研究进展[J]. 浙江中西医结合杂志, 2024, 34(4): 384-387, 392. |
| [8] |
KWAK T K, JANG H S, LEE M G, et al. Effect of orally administered Atractylodes macrocephala koidz water extract on macrophage and T cell inflammatory response in mice[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2018, 2018: 4041873. |
| [9] |
柳威, 邓林华, 赵英强. 白术及其有效成分药理作用概述[J]. 中医药学报, 2021, 49(10): 116-119. |
| [10] |
常潞, 荆文光, 程显隆, 等. 防风化学成分药理作用研究进展及质量标志物预测分析[J]. 中国现代中药, 2022, 24(10): 2026-2039. |
| [11] |
何云. 黔产金银花和山银花抗炎、免疫和保肝作用药效学对比研究[D]. 贵阳: 贵州大学, 2019.
|
| [12] |
郭宝, 朱向东. 中药连翘化学成分及药理活性最新进展[J]. 化工管理, 2022(30): 59-61. |
| [13] |
吴佳敏, 张晨阳, 卢芳国, 等. 免疫抑制剂对小鼠流感病毒性肺炎模型建立的影响[J]. 中国免疫学杂志, 2018, 34(10): 1446-1450. |
| [14] |
胡良平, 王琪. 中医药科研设计与统计分析[M]. 北京: 人民卫生出版社, 2011.
|
| [15] |
宋媛媛, 周越, 孙守兵, 等. 丁香苷对免疫功能低下小鼠的免疫调节作用[J]. 中药药理与临床, 2013, 29(2): 44-47. |
| [16] |
杨敬, 梁智辉, 徐勇. 纳米中药升白液抗环磷酰胺所致小鼠免疫损伤的研究[J]. 中医药导报, 2020, 26(5): 19-22. |
| [17] |
王小兰, 段鹏飞, 杨梦, 等. 生地黄多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节作用研究[J]. 上海中医药大学学报, 2021, 35(1): 55-60, 92. |
| [18] |
杜正彩, 侯小涛, 邓家刚, 等. 文蛤粗多肽对免疫抑制小鼠TNF-α, IL-2及IFN-γ的影响[J]. 广西中医药, 2014, 37(5): 71-74. |
| [19] |
钟起诚. 从中医药学与现代免疫学的联系探讨系统性红斑狼疮的发病机理及治疗[J]. 新中医, 2004, 36(2): 3-6. |
| [20] |
杨丽惠, 胡凯文, 王婧筱. 基于肝癌免疫微环境探讨活血化痰解毒法在肝癌中的作用机制[J]. 中国实验方剂学杂志, 2022, 28(14): 172-178. |
| [21] |
宋广福, 陈丽娜, 许玉凤, 等. 参芪扶正注射液对免疫低下小鼠的免疫调节作用及其机制研究[J]. 中医药导报, 2017, 23(20): 17-20. |
| [22] |
钟金凤, 方热军. 环磷酰胺免疫抑制机制及在动物模型上的应用[J]. 中国免疫学杂志, 2016, 32(10): 1541-1546. |
| [23] |
GONG Y, WU J, LI S T. Immuno-enhancement effects of Lycium ruthenicum Murr. polysaccharide on cyclophosphamide-induced immunosuppression in mice[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(11): 20631-20637. |
| [24] |
CHEN Z S, KWONG HUAT TAN B, CHAN S H. Activation of T lymphocytes by polysaccharide-protein complex from Lycium barbarum L[J]. International Immunopharmacology, 2008, 8(12): 1663-1671. DOI:10.1016/j.intimp.2008.07.019 |
| [25] |
陈龙云, 周艳艳, 陈会敏, 等. 槲皮苷联合电针疗法对免疫抑制小鼠免疫功能和抗氧化能力的影响[J]. 现代免疫学, 2019, 39(5): 361-369. |
| [26] |
卢迪, 王晓宇, 齐六卫, 等. 芪贞提取物对CTX诱导小鼠免疫低下的修复作用研究[J]. 中医药信息, 2022, 39(10): 15-18, 27. |
| [27] |
陈汀, 成旭东, 胡芳, 等. 扶正胶囊提取物对环磷酰胺诱导的免疫低下小鼠免疫调节作用研究[J]. 天津中医药大学学报, 2022, 41(4): 451-456. |
| [28] |
王兰芳, 吴晶, 刘鸿雁, 等. 芝芪康艾颗粒对免疫抑制小鼠免疫功能的调节作用[J]. 国际药学研究杂志, 2020, 47(12): 1129-1136. |
| [29] |
RIVINO L, LIM M Q. CD4+ and CD8+ T-cell immunity to Dengue-lessons for the study of Zika virus[J]. Immunology, 2017, 150(2): 146-154. DOI:10.1111/imm.12681 |
| [30] |
周鹏, 吕艳伟, 李静, 等. 吴茱萸碱通过NF-κB-p65信号通路抑制人结肠癌细胞SW480的迁移和侵袭[J]. 第三军医大学学报, 2019, 41(6): 549-555. |
| [31] |
YU H, LIN L B, ZHANG Z Q, et al. Targeting NF-κB pathway for the therapy of diseases: Mechanism and clinical study[J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 209. |
 2024, Vol. 43
2024, Vol. 43