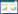文章信息
- 李鑫, 王敏, 邢斌, 贾欣陶, 刘志东
- LI Xin, WANG Min, XING Bin, JIA Xintao, LIU Zhidong
- 经典名方羌活胜湿汤中12种成分的LC-MS/MS定量分析
- Simultaneous determination of 12 components in Qianghuo Shengshi Decoction by liquid chromatography-tandem mass spectrometry
- 天津中医药大学学报, 2024, 43(9): 780-786
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(9): 780-786
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.09.03
-
文章历史
收稿日期: 2024-06-10
2. 天津中医药大学, 现代中药发现与制剂技术教育部工程研究中心, 天津 301617;
3. 天津中医药大学, 现代中医药海河实验室, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Haihe Laboratory of Modern Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
羌活胜湿汤是国家中医药管理局发布的《古代经典名方目录(第一批)》中的处方,最初见于李东垣所著《内外伤辨惑论》,由羌活、独活、防风、川芎、藁本、甘草、蔓荆子7种中药组成,具有祛风、胜湿、止痛、解表等功效[1-2]。西医常将其及其加减方或辅以其他治疗手段用于头痛[3-4]、颈椎病[5-6]、肩周炎[7-8]、关节炎[9-10]、过敏性紫癜[11-12]等疾病的治疗,疗效显著,其可通过丝裂原激活的蛋白激酶/cAMP应答元件结合蛋白(MAPKs/CREB)发挥抗炎镇痛的作用[13]。现有研究者采用高效液相色谱法测定羌活胜湿汤物质基准样品中的指标成分以进行质量控制,但是此法存在可测定的成分少、进样时间长等缺点[14]。液相色谱-质谱联用技术(LC-MS/MS)具有高选择性、高专属性、高灵敏度,线性范围宽等优点,能方便有效的测定中药化学成分的含量,可为中药质量控制提供可靠的参考[15-16]。因此,研究建立了可同时测定羌活胜湿汤颗粒中5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸12种成分的LC-MS/MS含量测定方法,以期为羌活胜湿汤颗粒的质量评价提供高效灵敏的检测方法。
1 材料 1.1 仪器液质联用仪(美国Agilent公司,含1290型高效液相色谱仪、6460型三重四级杆质谱仪,MassHunter工作站),Caleva搅拌扭矩流变仪(MTR3)(英国Caleva公司),KQ-400B型超声波清洗仪(昆山市超声仪器有限公司),FA124万分之一天平(天津亿诺科学仪器有限公司),AX205十万分之一天平(瑞士METTLER TOLEDO),Milli-Q超纯水机(美国Millipore公司)。
1.2 试剂及试药5-O-甲基维斯阿米醇苷(批号:11153-201811,纯度97.4%)、蛇床子素(批号:110822-201710,纯度99.5%)、二氢欧山芹醇当归酸酯(批号:111583-201605,纯度98.6%)、绿原酸(批号:110753-201817,纯度96.8%)、阿魏酸(批号:110773-201614,纯度99.0%)对照品均购买于中国食品药品检定研究所;紫花前胡苷(批号:102835,纯度 > 98%)对照品购买于江苏永健医药科技有限公司;蔓荆子黄素(批号:5185,纯度99.8%)、羌活醇(批号:7565,纯度98.0%)对照品购买于上海诗丹德标准技术服务公司;异甘草苷(批号:AF21072857,纯度≥98.0%)对照品购买于成都埃法科技有限公司;甘草苷(批号:213J11X108109,纯度≥98%)、甘草素(批号:C26A10Q87040,纯度≥98%)对照品购买于上海源叶科技生物有限公司;异甘草素(批号:WO5-1-3,纯度≥98.0%)对照品购买于天津中新药业集团股份有限公司;糊精(批号:20210811)购买于山东聊城阿华制药股份有限公司;无水乙醇(批号:211125)购买于天津市康科德科技有限公司;乙腈(批号:212522)、甲醇(批号:214804)为色谱纯,购买于Fisher Scientific公司;甲酸(批号:A3MMC-UV,LC-MS > 98%)购买于梯希爱(上海)化成工业发展有限公司;去离子水由Milli-Q超纯水机制备;羌活胜湿汤颗粒制备所用饮片由黑龙江珍宝岛药业股份有限公司提供,由天津中医药大学祁东利副研究员鉴定均符合2020年版《中华人民共和国药典》要求,其批次及产地见表 1。
色谱柱为ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm),流动相A为0.1%甲酸水溶液,B为乙腈,洗脱梯度为0~5 min,85%~80%A;5~10 min,80%~50%A;10~13 min,50%~40%A;13~18 min,40%~35%A;18~18.01 min,35%~85%A;18.01~20 min,85%A;流速为0.3 mL/min,柱温为30 ℃;进样量为5 μL。
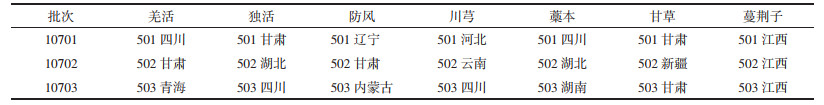
2.1.2 质谱条件采用多反应监测模式(MRM)同时扫描正负离子,电喷雾离子源(ESI),干燥器温度设定300 ℃,干燥器流量为11 L/min,雾化器压力为15 psi,毛细管电压为3 kV。12个指标成分的具体参数见表 2。
取适量水提得到的羌活胜湿汤干浸膏粉与糊精以1:1的比例混匀,放入搅拌扭矩流变仪中,搅拌速度为80 r/min,根据投料量加入85%乙醇0.25 mL/g,搅拌190 s,制得软材,过14目筛,于60 ℃干燥1 h,制备得羌活胜湿汤颗粒。
2.3 溶液配置 2.3.1 混合标准溶液的配置精密称定适量对照品,用甲醇溶解并稀释,制得浓度分别为5-O-甲基维斯阿米醇苷1 424 ng/mL、紫花前胡苷1 792 ng/mL、蔓荆子黄素1 252 ng/mL、羌活醇1 512 ng/mL、蛇床子素1 312 ng/mL、二氢欧山芹醇当归酸酯1 222 ng/mL、异甘草苷2 240 ng/mL、甘草苷2 705 ng/mL、绿原酸1 470 ng/mL、异甘草素2 216 ng/mL、甘草素1 620 ng/mL、阿魏酸1 504 ng/mL的混合标准溶液。
2.3.2 供试品溶液的配置精密称取研磨后的羌活胜湿汤颗粒0.2 g至50 mL具塞锥形瓶,精密移取10 mL 60%(V/V)甲醇,摇匀并称质量,超声45 min(320 W、40 kHz),时时振摇,取出冷却至室温后,用溶媒补足失质量,摇匀,取适量稀释,过0.22 μm有机微孔滤膜,即得。
2.4 方法学考察 2.4.1 专属性考察取空白溶剂、“2.3”项下标品溶液及供试品溶液进样分析,比较结果见图 1。结果表明样品中12个待测组分的分离度较高,峰形良好,且无溶剂峰干扰。
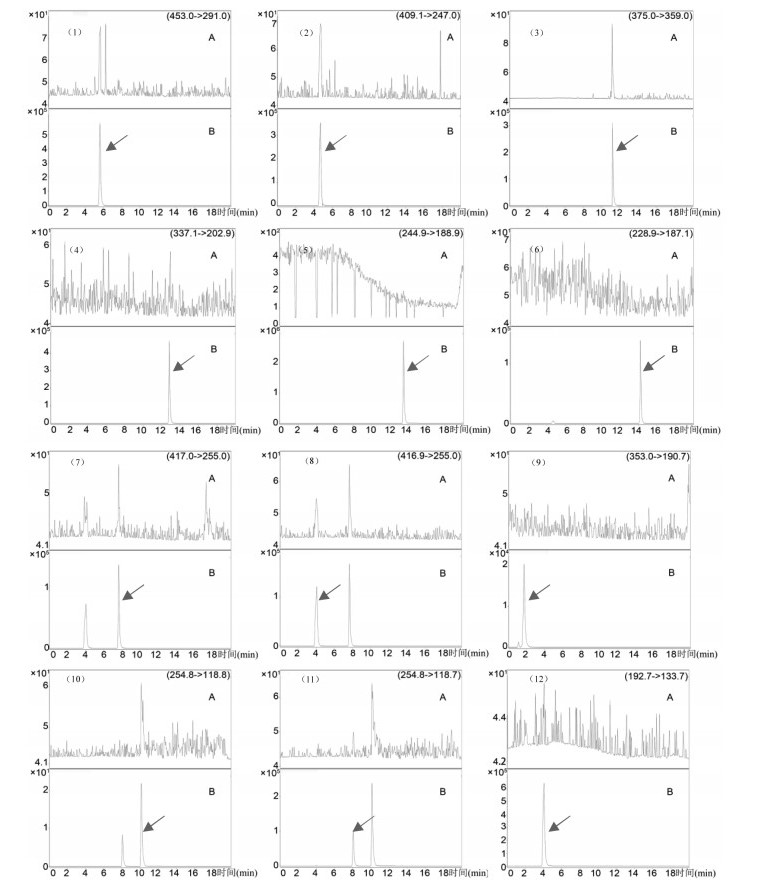
|
| 注:(1)5-O-甲基维斯阿米醇苷、(2)紫花前胡苷、(3)蔓荆子黄素、(4)羌活醇、(5)蛇床子素、(6)二氢欧山芹醇当归酸酯、(7)异甘草苷、(8)甘草苷、(9)绿原酸、(10)异甘草素、(11)甘草素、(12)阿魏酸专属性图谱;A,空白溶液;B,供试品溶液。 图 1 羌活胜湿汤颗粒中12种成分专属性图谱 |
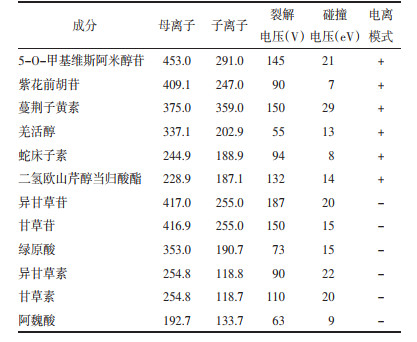
精密吸取“2.3.1”项下标品溶液适量,稀释成不同浓度的溶液,进样分析,记录峰面积,以浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,结果见表 3,此12种成分在各线性范围内线性关系良好。
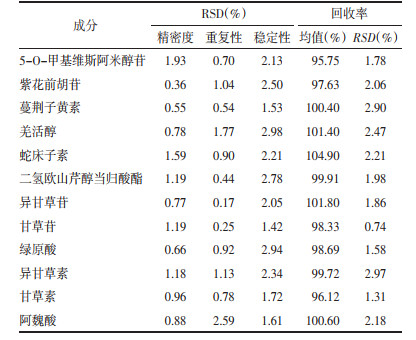
取“2.3.1”项下标品溶液连续进样6次,测得5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸RSD值见表 4,结果均小于3.00%,表明仪器精密度良好。
取按“2.3.2”项制备的同一批羌活胜湿汤颗粒供试品溶液进样分析(n=6),测得5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸RSD值见表 4,结果均小于3.00%,表明该方法重复性良好。
2.4.5 稳定性实验取按“2.3.2”项制备的供试品溶液,分别于制备后0、3、6、12、24 h进样分析,测定峰面积,计算RSD值,测得5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸RSD值见表 4,均小于3.00%,结果表明样品溶液各被测成分在24 h内稳定。
2.4.6 加样回收率实验取已知各成分含量的颗粒0.1 g,分别以指标成分含量的50% 加入各指标成分对照品储备液,按“2.3.2”项下方法制备样品,进样测定,计算各指标成分的回收率及RSD。5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸的平均回收率结果见表 4,各指标成分平均回收率均在95%~105%,RSD在0.74%~2.97%,结果表明加样回收率良好。
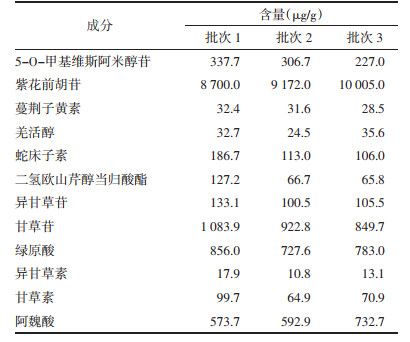
2.5 样品含量测定按“2.3.2”项下制备的各批次羌活胜湿汤颗粒供试品溶液,进样分析,代入随行标曲,计算得不同批次各成分的含量。见表 5。
羌活胜湿汤由7种中药组成,成分复杂,研究是从羌活胜湿汤发挥药效的潜在物质基础和药典中质量控制成分筛选出12种成分进行测定。根据2020年版《中国药典》,5-O-甲基维斯阿米醇苷是防风进行质量控制的成分,紫花前胡苷和羌活醇是羌活进行质量控制的成分,蔓荆子黄素是蔓荆子进行质量控制的成分,蛇床子素、二氢欧山芹醇当归酸酯是独活进行质量控制的成分,甘草苷是甘草进行质量控制的成分,阿魏酸是藁本和川芎进行质量控制的成分。5-O-甲基维斯阿米醇苷可以通过核因子κB/核因子κB抑制物α(NF-κB/IκB-α)通路降低炎症因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6、一氧化氮、丙二醛的含量,提高超氧化物歧化酶的含量,从而改善氧化应激,抑制脂多糖刺激的BV-2小胶质细胞的过度激活[17],孟莉等[18]研究者亦发现其可改善脂多糖诱导小鼠RAW264.7细胞的体外炎症,且具有浓度依赖性。羌活和独活是中医治疗中常用的药对,具有颇深的历史渊源[19],Wu等[20]通过使用网络药理学、代谢组学、肠道微生物群分析和生物学分析的综合模型,筛选得到紫花前胡苷、蛇床子素、二氢欧山芹醇当归酸酯等成分是这对中药中的药效成分。蔓荆子黄素具有抗癌、抗炎、镇痛、免疫调节、改善类风湿性关节炎等药理活性[21]。羌活醇能够逆转磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶(PI3K/AKT)和酪氨酸激酶2/信号转导与转录激活因子3(JAK2/STAT3)信号通路的激活抑制炎症因子的产生,激活核因子E2相关因子2/血红素加氧酶-1(Nrf2/HO-1)通路表现出抗凋亡活性,减少活性氧的释放,减轻TNF-α调节细胞外基质的降解和变性,缓解关节炎进展[22]。Ye等[23]发现羌活醇通过激活AKT/Nrf2/HO-1信号通路抑制脂多糖诱导的BV-2细胞炎症反应,减少细胞损伤。Wang等[24]研究者发现羌活醇结合并靶向JAK2和JAK3达到抑制炎症的目的,抑制JAK-STAT途径改善炎症和关节炎。Yu等[25]用异甘草苷持续治疗小鼠两周,研究结果发现异甘草苷以剂量依赖的方式改善了对热刺激的行为痛觉过敏和对触觉刺激的异常性疼痛。异甘草素具有很强的抗氧化应激、抗炎活性,能够减轻细胞损伤[26]。甘草苷可通过减少炎症发生、阻断MAPK信号传导和抑制新生血管来改善类风湿性关节炎[27]。Wahab等[28]详细综述了甘草的药理活性及化学成分等,发现异甘草素、甘草素等黄酮类化合物是甘草中的主要活性成分。绿原酸广泛存在于自然界多种植物中,因其可减轻氧化和炎症应激、保护肝肾、抗肿瘤、调节糖代谢和脂质代谢等作用而被很多研究者关注[29-32]。阿魏酸是1种天然酚类化合物,具有抗炎、抗氧化和调节血脂水平等功能,已被广泛应用于医药和食品行业[33-35]。
3.2 色谱条件优化考察含量测定色谱条件时,以不同比例流动相体系(甲醇-水、甲醇-0.1%甲酸水、乙腈-水、乙腈-0.1%甲酸水、乙腈-0.05%甲酸水)进行梯度洗脱,结果表明,当有机相为甲醇时,存在溶剂效应,峰形出现“M”峰;若流动相中未加甲酸时,峰拖尾严重,其响应较低,且流动相为乙腈-0.1%甲酸水响应高于乙腈-0.05%甲酸水的响应,故选择乙腈-0.1%甲酸水溶液为洗脱溶剂进行梯度洗脱。
3.3 质谱条件的优化液质联用技术将色谱及质谱优势进行互补,具有选择性强、灵敏度高、分离能力好、耗时短等优点,研究采用该技术建立了同时测定羌活胜湿汤颗粒中12种成分的含量测定方法。考察了不同成分在正负离子模式下的响应,甘草素、异甘草素、甘草苷、异甘草苷、绿原酸、阿魏酸在负离子模式下的响应高于正离子模式,其他成分在正离子模式下响应更高,采用正负离子切换模式时,极性相似的成分无法在短时间内完全分离,所以选用正负离子同时扫描,可以节省时间,响应值高。
3.4 样品处理方法的优化对羌活胜湿汤颗粒超声提取的提取溶剂、提取时间、超声功率进行了考察,考察的提取溶剂有纯水、乙腈、甲醇和乙醇,结果表明,当不同比例的甲醇作为溶媒时,各成分峰形好,响应较高,故优选甲醇作为提取溶媒,其中50%、60%、75%甲醇提取响应均无较大差别,但是考虑到样品的稳定性,故选择60%甲醇作为提取溶媒。对提取时间进行了30、45、60 min的考察,对超声功率进行了240、320、400 W的考察,根据峰形、响应及样品状态,最终确定提取时间为45 min,超声功率为320 W。
研究采用LC-MS/MS法同时测定羌活胜湿汤颗粒中5-O-甲基维斯阿米醇苷、紫花前胡苷、蔓荆子黄素、羌活醇、蛇床子素、二氢欧山芹醇当归酸酯、异甘草苷、甘草苷、绿原酸、异甘草素、甘草素、阿魏酸12种成分含量的方法,该方法具有快速、高效、灵敏的特点,可为羌活胜湿汤颗粒的质量控制和更深入的研究提供参考。
| [1] |
董燕, 侯酉娟, 李莎莎, 等. 经典名方羌活胜湿汤的古代文献分析[J]. 中国实验方剂学杂志, 2018, 24(17): 1-5. |
| [2] |
谭志强, 熊和平, 易腾达, 等. 羌活胜湿汤功能主治衍变与剂量变化关联考证[J]. 中医学报, 2021, 36(6): 1350-1356. |
| [3] |
张爱婷, 赵素霞, 刘文娟, 等. 羌活胜湿汤对风湿外感头痛患者的疗效分析[J]. 广州医药, 2022, 53(4): 65-68. |
| [4] |
何金波, 张晓云. 川芎茶调散合羌活胜湿汤治疗偏头痛随机平行对照研究[J]. 实用中医内科杂志, 2016, 30(5): 96-98. |
| [5] |
黄子亮, 罗湘艳, 黄海珍. 羌活胜湿汤加减结合中频脉冲电疗法治疗颈型颈椎病的临床研究[J]. 中国中医急症, 2019, 28(3): 461-463, 471. |
| [6] |
李新伟, 谭克平, 杜嘉, 等. 羌活胜湿汤配合针刺治疗颈型颈椎病(风寒湿型)的疗效观察[J]. 中国现代应用药学, 2017, 34(6): 894-897. |
| [7] |
劳佳宁, 朱荣耀, 金建淼. 羌活胜湿汤加味联合关节松动术治疗肩周炎临床研究[J]. 新中医, 2022, 54(20): 18-21. |
| [8] |
谢明玉. 羌活胜湿汤联合玻璃酸钠关节腔内注射治疗肩周炎的疗效分析[J]. 江西医药, 2015, 50(10): 1035-1036. |
| [9] |
王庆超. 羌活胜湿汤治疗膝关节骨性关节炎临床观察[J]. 光明中医, 2021, 36(23): 3937-3940. |
| [10] |
熊雨墨, 李瑛, 马毅, 等. 除湿解毒汤合羌活胜湿汤加减治疗急性痛风性关节炎(湿热蕴结证)的临床研究[J]. 中国中医急症, 2021, 30(6): 1053-1056. |
| [11] |
吴雪华. 羌活胜湿汤加减治疗过敏性紫癜42例[J]. 吉林中医药, 2003, 23(10): 26-27. |
| [12] |
陈圣丽, 刘继峰, 唐旭, 等. 85例过敏性紫癜临床特点及中医证型临床分析[J]. 中华中医药学刊, 2012, 30(5): 1107-1109. |
| [13] |
HU N, WANG C H, WANG B H, et al. Qianghuo Shengshi decoction exerts anti-inflammatory and analgesic via MAPKs/CREB signaling pathway[J]. Journal of Ethnopharmacology, 2022, 284: 114776. |
| [14] |
高文雅, 徐赫, 周严严, 等. 羌活胜湿汤指标成分含量测定方法建立及量值传递研究[J]. 中国中医药信息杂志, 2023, 30(8): 131-135. |
| [15] |
祁昆, 王洋, 陈涛, 等. 液质联用在中药复方制剂研究中的应用[J]. 天津中医药大学学报, 2017, 36(5): 396-400. |
| [16] |
张黎媛. 液质联用技术在中药质量控制中的应用[J]. 世界中医药, 2018, 13(2): 513-516, 521. |
| [17] |
SUN X L, ZHANG T W, ZHAO Y, et al. The protective effect of 5-O-methylvisammioside on LPS-induced depression in mice by inhibiting the over activation of BV-2 microglia through Nf-κB/IκB-α pathway[J]. Phytomedicine, 2020, 79: 153348. |
| [18] |
孟莉, 高龙妹, 刘小虎, 等. 防风中5-O-甲基维斯阿米醇苷抗炎作用及机制研究[J]. 中华中医药学刊, 2023, 41(4): 214-217, 295. |
| [19] |
杜肖, 王亚鹏, 钱锦秀, 等. 经典名方中独活与羌活的本草考证[J]. 中国实验方剂学杂志, 2023, 29(5): 68-83. |
| [20] |
WU S S, XU X X, SHI Y Y, et al. System pharmacology analysis to decipher the effect and mechanism of active ingredients combination from herb couple on rheumatoid arthritis in rats[J]. Journal of Ethnopharmacology, 2022, 288: 114969. |
| [21] |
CHAN E W C, WONG S K, CHAN H T. Casticin from Vitex species: a short review on its anticancer and anti-inflammatory properties[J]. Journal of Integrative Medicine, 2018, 16(3): 147-152. |
| [22] |
QU Y H, QIU L, QIU H, et al. Notopterol alleviates the progression of osteoarthritis: an in vitro and in vivo study[J]. Cytokine, 2023, 169: 156309. |
| [23] |
YE B J, HE D W, HU J P, et al. Notopterol inhibits LPS-induced inflammation in BV-2 cells via AKT/Nrf2/HO-1 signaling axis[J]. International Immunopharmacology, 2023, 120: 110334. |
| [24] |
WANG Q, ZHOU X, YANG L, et al. The natural compound notopterol binds and targets JAK2/3 to ameliorate inflammation and arthritis[J]. Cell Reports, 2020, 33(8): 108442. |
| [25] |
YU C, ZHANG Y, GAO K X, et al. Serotonergically dependent antihyperalgesic and antiallodynic effects of isoliquiritin in a mouse model of neuropathic pain[J]. European Journal of Pharmacology, 2020, 881: 173184. |
| [26] |
CHEN L S, ZHENG D S. Protective effects of Isoliquiritin on Beas-2B cells against LPS-induced oxidative stress and inflammation involving activation of Nrf2[J]. Acta Poloniae Pharmaceutica - Drug Research, 2021, 78(3): 353-359. |
| [27] |
ZHAI K F, DUAN H, CUI C Y, et al. Liquiritin from Glycyrrhiza uralensis attenuating rheumatoid arthritis via reducing inflammation, suppressing angiogenesis, and inhibiting MAPK signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2019, 67(10): 2856-2864. |
| [28] |
WAHAB S, ANNADURAI S, ABULLAIS S S, et al. Glycyrrhiza glabra(licorice): a comprehensive review on its phytochemistry, biological activities, clinical evidence and toxicology[J]. Plants(Basel, Switzerland), 2021, 10(12): 2751. |
| [29] |
LIANG N J, KITTS D D. Role of chlorogenic acids in controlling oxidative and inflammatory stress conditions[J]. Nutrients, 2015, 8(1): 16. |
| [30] |
TAJIK N, TAJIK M, MACK I, et al. The potential effects of chlorogenic acid, the main phenolic components in coffee, on health: a comprehensive review of the literature[J]. European Journal of Nutrition, 2017, 56(7): 2215-2244. |
| [31] |
WANG L, PAN X Q, JIANG L S, et al. The biological activity mechanism of chlorogenic acid and its applications in food industry: a review[J]. Frontiers in Nutrition, 2022, 9: 943911. |
| [32] |
NWAFOR E O, LU P, ZHANG Y, et al. Chlorogenic acid: Potential source of natural drugs for the therapeutics of fibrosis and cancer[J]. Translational Oncology, 2022, 15(1): 101294. |
| [33] |
BUMRUNGPERT A, LILITCHAN S, TUNTIPOPIPAT S, et al. Ferulic acid supplementation improves lipid profiles, oxidative stress, and inflammatory status in hyperlipidemic subjects: a randomized, double-blind, placebo-controlled clinical trial[J]. Nutrients, 2018, 10(6): 713. |
| [34] |
ZDUSKA K, DANA A, KOLODZIEJCZAK A, et al. Antioxidant properties of ferulic acid and its possible application[J]. Skin Pharmacology and Physiology, 2018, 31(6): 332-336. |
| [35] |
LI D, RUI Y X, GUO S D, et al. Ferulic acid: A review of its pharmacology, pharmacokinetics and derivatives[J]. Life Sciences, 2021, 284: 119921. |
 2024, Vol. 43
2024, Vol. 43