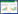文章信息
- 韩燕燕, 郑旭, 兰福, 李翀
- HAN Yanyan, ZHENG Xu, LAN Fu, LI Chong
- 消岩汤介导TNKS抑制肺腺癌细胞生长的初步探讨
- Preliminary study on inhibition of lung adenocarcinoma cellsgrowth by Xiaoyan Decoction mediating TNKS
- 天津中医药, 2022, 39(11): 1432-1438
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(11): 1432-1438
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.11.14
-
文章历史
- 收稿日期: 2022-07-12
2. 国家中医针灸临床医学研究中心, 天津 300381
肺癌是当今世界上对人类健康与生命危害最大的恶性肿瘤,近年来肺腺癌发病在世界范围内呈上升趋势[1]。端锚聚合酶(TNKS)可通过维持端粒长度保证肿瘤细胞持续生长繁殖,研究证实TNKS在肝癌、乳腺癌、肺癌等多种恶性肿瘤中均高表达[2-4],且与肿瘤的发生、发展、侵袭和转移密切相关。TNKS有望成为特异性治疗恶性肿瘤的颇有前景的新靶点。目前研究表明中药复方消岩汤具有抑制肿瘤细胞增殖,诱导细胞凋亡,逆转肺癌耐药,减轻化疗毒副作用等功效[5-8],结合中西医结合治疗肺腺癌思路,进一步探讨消岩汤是否通过介导TNKS来抑制肺腺癌细胞的生长。本文采用免疫组化法检测TNKS在肺腺癌组织中的表达情况,通过体外加入消岩汤及改变肺腺癌细胞株A549中TNKS表达检测肿瘤细胞在增殖、DNA损伤及修复、迁移及侵袭等方面的变化,旨在为肺腺癌的治疗提供新依据。
1 材料与方法 1.1 材料收集2017年1月—2017年12月天津中医药大学第一附属医院病理科存档的37例经两名主任医师确诊为肺腺癌患者的癌组织和癌旁组织,本研究组织样本的使用得到了天津中医药大学第一附属医院医学伦理委员会的批准。肺腺癌细胞株A549购自中国科学院上海细胞生物学研究所。
1.2 主要试剂消岩汤剂购自天津中医药大学第一附属医院,主要成分包括炙黄芪30 g,郁金10 g,蕲蛇5 g,党参15 g;兔抗人多克隆TNKS抗体(sc-8337)购自Santa Cruz生物技术公司;兔抗人γ-H2AX抗体(9718T)购自Cell Signaling Technology司;TNKS siRNA序列由上海吉玛制药技术有限公司设计合成(模板序列:上游引物5’-UAUCCAAGCGCUCUUCCCAAACUCCTT-3’,下游引物5’-GGAGUUUGGGAAGAGCGCUUGGAUATT-3’);实时荧光定量聚合酶联反应(qRT-PCR)试剂盒购自天根生化科技有限公司;同源重组(HR)修复试剂盒购自Norgen Biotek公司;细胞DNA提取试剂盒购自Thermo Fisher公司;CCK8试剂盒购自北京碧云天生物技术公司;SP试剂盒(SP-9001)、EDTA抗原修复液、DAB显色试剂购自中杉金桥生物技术有限公司。山羊分离血清(Cat No.ZLI-9022)购自OriGene科技有限公司。
1.3 方法 1.3.1 免疫组织化学检测将蜡块切成4 μm厚的切片,依次经二甲苯脱蜡,梯度乙醇水化;高压抗原修复后滴加3% H2O2室温孵育20 min,磷酸缓冲盐溶液(PBS)冲洗后滴加山羊血清,室温封闭30 min;滴加一抗TNKS(1∶800)、γ-H2AX(1∶500),4 ℃孵育过夜,DAB显色后苏木素复染;无水乙醇脱水、二甲苯透明后中性树胶封片、镜检。
1.3.2 细胞培养及实验分组A549细胞置于RPMI-1640完全培养基及梯度浓度消岩汤(0 mg/mL、1 mg/mL、5 mg/mL、10 mg/mL、50 mg/mL、100 mg/mL)中,饱和湿度培养箱内37 ℃,5% CO2,常规培养24 h。实验分为4组,包括空白对照组:A549细胞置于RPMI-1640完全培养基中培养24 h;阴性对照组:细胞转染时,将阴性对照siRNA转染人A549细胞中,6 h后用于后续实验;TNKSsiRNA组(TNKS下调组):细胞转染时,将TNKS siRNA转染人A549细胞中,6 h后用于后续实验;消岩汤组:用生理盐水将消岩汤剂充分溶解,用0.22 μm过滤器灭菌,并用培养基稀释至所需浓度。
1.3.3 蛋白免疫印迹法(Western Blot)检测取出蛋白样品,浓度测定后,按每孔20 μg上样,按照海绵-滤纸-胶-聚偏氟乙烯(PVDF)膜-滤纸-海绵的顺序进行转膜,转膜后经脱脂奶粉的TBST封闭1 h;一抗TNKS(1∶800)4 ℃摇床孵育过夜;二抗(1∶40 000)室温下摇床孵育1 h;最后将膜置于等体积混合的ECL A/B液中,室温孵育2 min,化学曝光机曝光,保存曝光图片。
1.3.4 qRT-PCR检测用TRIzol试剂提取总RNA,使用逆转录酶试剂盒将总RNA转化为cDNA。然后,对每份样本进行3次实时PCR分析。PCR引物为TNKS上游引物CGCGTGTCTGTTGTAGAGTA,下游引物GGAGCTTGCAGATTTCATAC。扩增片段长度220 bp;内参β-actin上游引物5’-TGACGTGGACATCCGCAAAG-3’,下游引物5’-CTGGAAGGTGGACAGCGAGG-3’,扩增片段长度205 bp。
1.3.5 CCK-8实验将A549细胞悬液(1×109/L)按每孔100 μL体积加入96孔板中。每组6个复孔,各组细胞处理后在适当的时间点(24、48或72 h),向每个孔中加入10 μL CCK-8溶液,培养4 h后,酶联免疫检测仪上测定450 nm波长处吸光度(OD)值。
1.3.6 细胞免疫荧光检测A549细胞培养至密度达80%,将其黏附到载玻片上,各组细胞处理48 h后,用4%多聚甲醛固定15 min。将细胞与0.5% Triton X-100(PBS化合物)孵育20 min,山羊分离血清25 ℃孵育30 min。然后将细胞与γ-H2AX单克隆抗体(1∶100)在4 ℃孵育过夜。第2天,FITC共轭山羊抗小鼠抗体(1∶100)黑暗中孵育60 min。DAPI复染细胞核5 min。荧光显微镜(×200倍)捕获图像。
1.3.7 同源重组DNA修复实验采用基于定量PCR方法的同源重组修复试剂盒检测不同处理组细胞的同源重组DNA修复能力。在TNKS siRNA转染24 h后,再将2个pUC19质粒(dl1和dl2)共转染到不同细胞中,继续培养48 h后,提取细胞DNA。然后利用HR修复试剂盒中的引物对DNA进行PCR扩增。PCR的反应条件为:3 min 95 ℃,然后15 s 95 ℃,30 s 61 ℃,1 min 72 ℃,共循环40次。
1.3.8 细胞划痕实验用黑色标记笔在6孔板背后均匀的划横线,将A549细胞(1×105/孔浓度)按每孔2.5 mL体积接种于该6孔板中,待细胞贴壁后,用无菌枪头垂直于背后横线划痕,PBS冲洗3次后拍照,继续按分组情况无血清培养,0、12、24、48 h同一观察点处拍照。划痕修复率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度。
1.3.9 Transwell实验将A549细胞悬液(2×105/L)200 μL加入到含有matrigel的Transwell小室的上室,同时向24孔板下室中加入500 μL的含20% 血清的培养基。将上室放入24孔板中,24 h后,用拭子轻轻去除上室表面的细胞,用4%多聚甲醛固定已发生穿膜的细胞,并用2.5%结晶紫染色。倒置显微镜下随机选取5个视野(×100)观察细胞并计数,实验重复3次。
1.4 免疫组化结果判定镜检显示细胞膜、细胞浆、和(或)细胞核内出现棕黄色颗粒为阳性。每张切片于高倍镜下(×400)随机取5个视野,每个视野计数100个细胞。阳性细胞百分比:阳性细胞 < 5%为0分,5%~25%为1分,25%~ 50%为2分,50%~75%为3分,> 75%为4分。阳性细胞着色强度:无色0分,浅黄色1分,棕黄色2分,棕褐色3分。组织化学的最终评分为阳性细胞的百分比和着色强度的相乘结果。总评分:0~3分为阴性(-),3~6分为弱阳性(+),6~9分为中等阳性(++),> 9分为强阳性(+++)。
1.5 统计学分析采用SPSS 16.0软件对数据进行统计学分析,数据以均数±标准差(x±s)表示。多个均数比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法;计数资料采用率表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。
2 结果 2.1 TNKS蛋白在肺腺癌组织及癌旁中的表达情况TNKS蛋白表达于细胞浆,肺腺癌组织及癌旁组织阳性表达率分别为63.00%(27/37)、18.92%(7/37),与癌旁组织比较,癌组织的阳性表达率升高,差异有统计学意义(P < 0.05)。见图 1。

|
| 注:A. 肺腺癌组织及癌旁组织[苏木精-伊红(HE)染色,×100]左下角为肺腺癌,右上角为癌旁组织;B. 肺腺癌组织中TNKS蛋白的表达(免疫组化法,×400)。 图 1 TNKS蛋白在肺腺癌组织及癌旁组织中的表达 Fig. 1 Protein expression of TNKS in lung adenocarcinoma tissues and adjacent tissues |
随消岩汤浓度升高,细胞中TNKS mRNA表达水平降低。且与空白对照组相比,10 mg/mL、50 mg/mL、100 mg/mL消岩汤处理后细胞中TNKS mRNA表达水平降低,差异有统计学意义(P < 0.05)。见图 2。不同剂量消岩汤之间两两比较均无统计学意义,后续选择10 mg/mL消岩汤用于实验。
|
| 注:组间比较,*P<0.05。 图 2 梯度浓度消岩汤处理A549细胞后TNKS mRNA的表达水平 Fig. 2 Expression of TNKS mRNA after treatment with gradient concentration Xiaoyan Decoction in A549 cells |
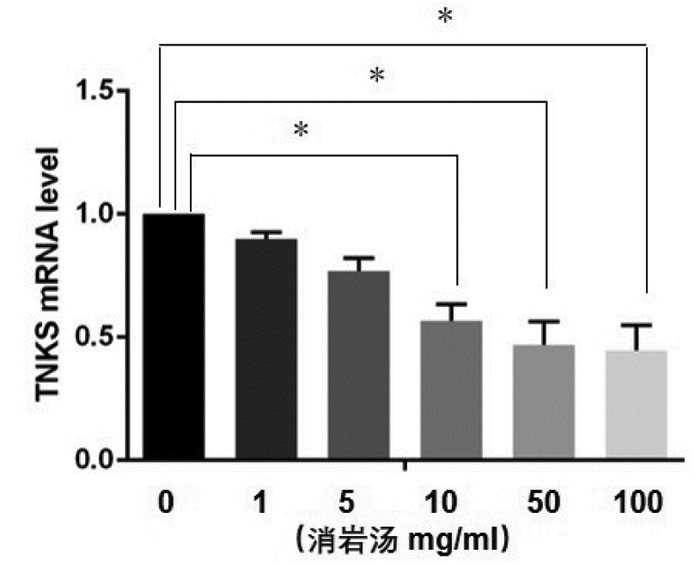
与空白对照组、阴性对照组相比,TNKS siRNA组中细胞TNKS蛋白(见图 3A、B)及mRNA(见图 3C)表达量减少,差异有统计学意义(P < 0.05)。
|
| 注:组间比较,**P<0.01。 图 3 Western Blot及qRT-PCR法检测TNKS的蛋白及mRNA表达 Fig. 3 Protein and mRNA expressions of TNKS detected by Western Blot and qRT-PCR |
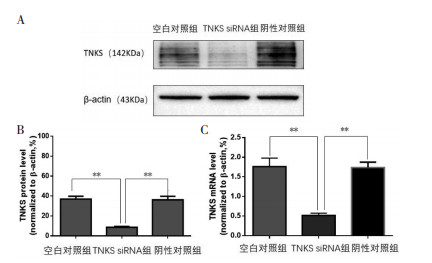
与空白对照组相比,48 h及72 h后,TNKS siRNA组及消岩汤组细胞增殖活性随作用时间的延长而逐渐降低,差异有统计学意义(P < 0.05),见图 4。
|
| 注:组间比较,*P<0.05,**P<0.01。 图 4 不同处理组细胞的增殖活性 Fig. 4 Proliferation activity of cells in different treatment groups |
与空白对照组相比,阴性对照组γH2AX荧光表达无明显影响,差异无统计学意义(P > 0.05);与TNKS siRNA组相比,消岩汤组无统计学意义(P > 0.05);与空白对照组相比,TNKS siRNA组及消岩汤组的γ-H2AX荧光表达均明显增强,差异有统计学意义(P < 0.05)。见图 5。
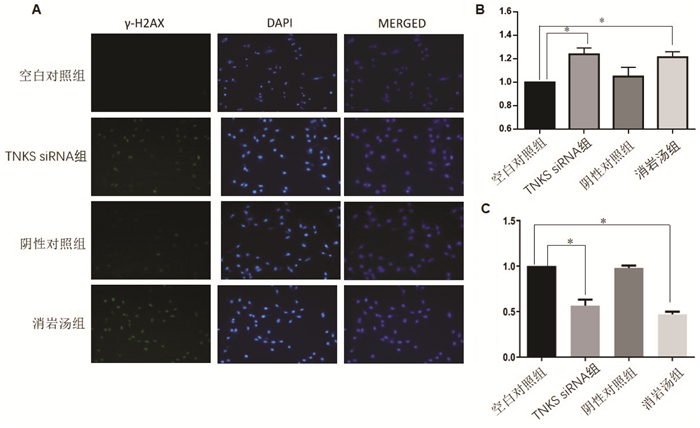
|
| 注:组间比较,*P<0.05。 图 5 不同处理组γ-H2AX的荧光表达情况 Fig. 5 Fluorescence expression of γ-H2AX in different treatment groups |
与空白对照组相比,阴性对照组的DNA修复能力差异无统计学意义(P > 0.05);TNKS siRNA组及消岩汤组DNA修复能力表达明显减弱,差异有统计学意义(P < 0.05)。见图 6。
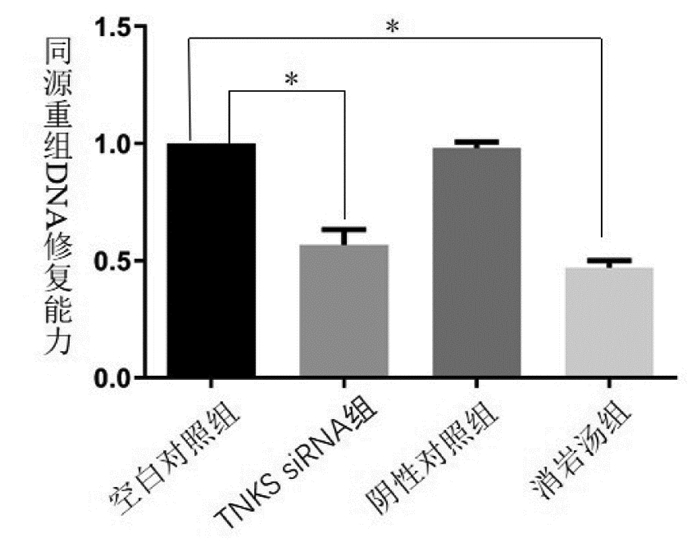
|
| 注:组间比较,*P<0.05。 图 6 不同处理组同源重组DNA修复能力 Fig. 6 Repair ability of homologous recombinant DNA in different treatment groups |
空白对照组、TNKS siRNA组、阴性对照组及消岩汤组细胞处理48 h后,各组细胞的划痕愈合率分别为(43.12±2.34)%、(8.98±0.513)%、(40.71%±3.50)%和(9.343±1.212)%,与对照组相比,TNKS siRNA组、消岩汤组细胞迁移能力下降,差异有统计学意义(P < 0.01),见图 7A、7B。阴性对照组细胞迁移能力稍下降,差异无统计学意义(P > 0.05)。与TNKS siRNA组相比,消岩汤组细胞迁移能力差异无统计学意义(P > 0.05)。
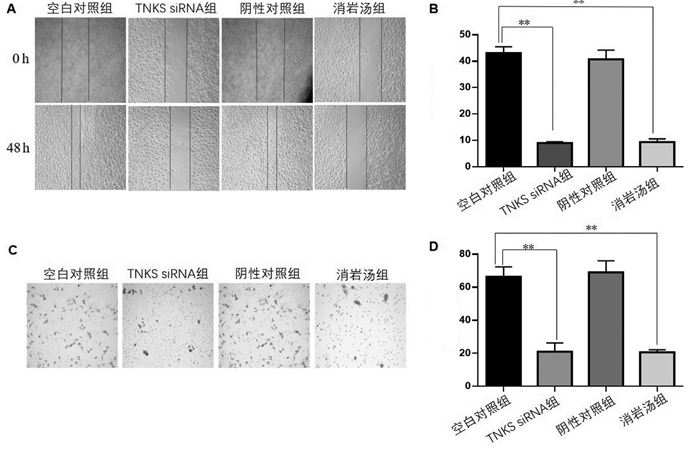
|
| 图 7 不同处理组细胞迁移与侵袭能力 Fig. 7 Migration and invasion ability of cells in different treatment groups |
空白对照组、TNKS siRNA组、阴性对照组及消岩汤组细胞处理48 h后,各组细胞穿过小室膜发生侵袭的细胞数分别为(66.30±6.00)、(21.00±5.30)、(69.00±7.00)和(20.70±1.50)个。结果显示,与对照组相比,TNKS siRNA组及消岩汤组细胞穿膜细胞数降低,差异有统计学意义(P < 0.01)。见图 7C、7D。与TNKS siRNA组相比,消岩汤组细胞穿膜细胞数差异无统计学意义(P > 0.05)。
3 讨论肺癌是世界癌症病死率之首,虽然目前肺癌的病死率较以往有所下降,但因其早期发病隐匿,缺乏特异性,一经发现已属晚期,很难通过手术完全根治,而且肿瘤侵袭性较强,大多数肺癌患者在手术、放疗或化疗后不久发生肿瘤转移和复发,5年相对生存率极低,严重影响着人们的健康[9]。
中医药具有良好的经济价值,且不良反应较少,在临床上应用广泛。消岩汤是天津中医药大学第一附属医院以人参、郁金、夏枯草、黄芪等药抗癌扶正、解毒祛瘀研发出的院内制剂,已广泛应用于临床十余年,主要涉及肺癌、乳腺癌、肝癌等[10-11]。前期研究发现[12],消炎汤作用于肺腺癌细胞后,TNKS蛋白表达明显下调,且XAV939(TNKS的小分子抑制剂)可通过下调Wnt通路抑制肺腺癌A549细胞的增殖和转移。
TNKS是一种位于端粒的聚腺苷二磷酸核糖聚合酶,具有PARP催化域,它在端粒酶阳性细胞中过表达,可使端粒长度增加,从而影响染色体的稳定性,使肿瘤细胞可以无限增殖。目前TNKS特异性抑制剂主要包括G007-LK、E7449、RK-287107、NV G-631和JW55 [13-15]。G007-LK可以抑制小肠LGR5+干细胞增殖;RK-287107不仅能抑制PARP1酶的活性,还可以通过阻断β-catenin信号通路,抑制人结直肠癌细胞的肿瘤生长;研究报道XAV939是首个报道的tankyrase选择性聚腺苷二磷酸-核糖多聚酶(PARP)抑制剂,XAV939可抑制TNKS 1和TNKS 2的(PARP)活性,使轴蛋白(Axin)活性增强,加速β-catenin磷酸化降解,从而阻滞Wnt信号通路,阻滞癌基因的激活,最终抑制肿瘤的发生发展。本课题组前期研究[12]结果显示,XAV939对肺腺癌细胞A549的增殖抑制作用有明显的浓度依赖性和时间依赖性,与以上学者研究相符,且检测发现A549细胞的TNKS蛋白表达水平高于Calu-3和SK-LU-1细胞。本实验利用qRT-PCR法检测梯度浓度消岩汤作用于A549细胞后TNKS mRNA的表达情况,结果显示随消岩汤浓度升高,A549细胞中TNKS表达降低。另外本研究通过回顾性分析,与癌旁组织相比,肺腺癌组织中TNKS的表达显著增高。如若抑制端粒酶TNKS活性是否可以诱导端粒缩短,最终引起细胞衰老和死亡。
因此,本研究进一步通过使用体外下调技术,寻求确认TNKS在调节肺腺癌发生及进展中的作用,探讨消岩汤是否通过抑制TNKS表达抑制A549细胞增殖、迁移、侵袭,增加细胞DNA损伤并抑制DNA修复能力。CCK8实验结果表明,下调TNKS的表达显著抑制了A549细胞的活性及增殖能力,与消岩汤组相同,提示消岩汤可能通过下调TNKS的表达抑制A549细胞的增殖。
人类绝大多数体细胞缺乏端粒酶活性,端粒长度缩短,细胞DNA受损,导致细胞死亡和凋亡,而肿瘤细胞端粒酶活性可保持在一个较高水平。有研究报道TNKS抑制剂XAV939,可增加诱导DNA双链断裂的抗癌药物的敏感性,并与DNA损伤抗癌药物联合治疗具有潜在的治疗作用[16]。磷酸化的H2AX(γH2AX)是DNA损伤的敏感新标志物,目前的研究表明,下调TNKS后,A549细胞γH2AX荧光表达明显增强,给予消岩汤处理的A549细胞γH2AX荧光表达也增强。结果提示,下调TNKS及给予消岩汤都会增加细胞的DNA损伤,同时抑制同源重组DNA修复能力。
下调TNKS后伤口愈合实验的结果显示,与对照组相比,TNKS下调组细胞划痕愈合率降低,提示下调TNKS后A549细胞迁移能力下降,同样下调TNKS后细胞侵袭实验结果显示:与对照组相比,TNKS下调组细胞侵袭细胞数减少,提示下调TNKS后A549细胞侵袭能力降低。以上结果与消岩汤组一致。再一次验证既往研究报道,如下调TNKS表达可抑制大肠癌、前列腺癌的增殖[17];在肝细胞癌细胞中,下调TNKS表达可抑制肿瘤细胞的增殖、迁移和侵袭[18]等。
综上所述,下调TNKS可以抑制A549细胞的增殖、迁移和侵袭能力,TNKS的异常表达在肺腺癌的发生、发展、侵袭和转移过程中起着重要的作用,抑制TNKS的活性或阻断其作用位点有可能成为治疗肺腺癌的新方法。中药消岩汤可降低TNKS的表达,具有抑制A549细胞增殖、迁移和侵袭的生物学特性,其机制可能与TNKS相关。然而肺腺癌发生发展是多基因多因素相互作用的结果,消岩汤抑制肺腺癌生长的具体机制有待于进一步深入研究。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. Cancer Journal for Clinicians, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
LI N, WANG Y F, NERI S, et al. Tankyrase disrupts metabolic homeostasis and promotes tumorigenesis by inhibiting LKB1-AMPK signalling[J]. Nature Communications, 2019, 10: 4363. DOI:10.1038/s41467-019-12377-1 |
| [3] |
YANG J, ZHANG X M, CHEN Z L, et al. Angiomotin-p130 inhibits β-catenin stability by competing with Axin for binding to tankyrase in breast cancer[J]. Cell Death & Disease, 2019, 10(3): 179. |
| [4] |
OKUNLOLA F O, AKAWA O B, SUBAIR T I, et al. Unravelling the mechanistic role of quinazolinone pharmacophore in the inhibitory activity of bis-quinazolinone derivative on tankyrase-1 in the treatment of colorectal cancer (CRC) and non-small cell lung cancer (NSCLC): a computational approach[J]. Cell Biochemistry and Biophysics, 2022, 80(1): 1-10. DOI:10.1007/s12013-021-01027-3 |
| [5] |
郑旭, 韩燕燕, 顾丽丽, 等. 消岩汤通过WNT通路抑制肺腺癌A549细胞增殖、促进细胞凋亡的机制研究[J]. 天津中医药, 2022, 39(3): 369-374. ZHENG X, HAN Y Y, GU L L, et al. Study on the mechanism of Xiaoyan Decoction inhibiting proliferation and promoting apoptosis of lung adenocarcinoma A549 cells through WNT pathway[J]. Tianjin Journal of Traditional Chinese Medicine, 2022, 39(3): 369-374. |
| [6] |
赵林林, 王艳亭, 王晓群, 等. 消岩汤治疗非小细胞肺癌临床及基础研究进展[J]. 中草药, 2022, 53(2): 627-634. ZHAO L L, WANG Y T, WANG X Q, et al. Clinical and basic research progress on Xiaoyan Decoction in treatment of nonsmall cell lung cancer[J]. Chinese Traditional and Herbal Drugs, 2022, 53(2): 627-634. |
| [7] |
FANMING K, YANG Y, RENFEN D, et al. Xiaoyan Decoction inhibits tumor growth and improves the immunity of mouse with A549 lung carcinoma xenograft[J]. TMR肿瘤, 2019(4): 227-232. |
| [8] |
刘宏根, 杨佩颖, 赵林林, 等. 消岩汤逆转肺癌顺铂耐药的机制研究[J]. 中草药, 2020, 51(9): 2486-2491. LIU H G, YANG P Y, ZHAO L L, et al. Mechanism of reversing cisplatin resistance by Xiaoyan Decoction in lung cancer[J]. Chinese Traditional and Herbal Drugs, 2020, 51(9): 2486-2491. |
| [9] |
ZHAO Y, FENG C, LI Y, et al. LncRNA H19 promotes lung cancer proliferation and metastasis by inhibiting miR-200a function[J]. Molecular and Cellular Biochemistry, 2019, 460(1/2): 1-8. |
| [10] |
朱津丽, 张硕, 张莹, 等. 消岩汤联合化疗对晚期非小细胞肺癌患者外周血VEGF的影响及其临床疗效[J]. 天津中医药, 2020, 37(1): 38-43. ZHU J L, ZHANG S, ZHANG Y, et al. Effect and clinical efficacy of Xiaoyan Decoction combined with chemotherapy on peripheral blood vascular endothelial growth factor in patients with advanced non-small cell lung cancer[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 38-43. |
| [11] |
诸葛晶哲, 易丹, 张莹. 消岩汤治疗晚期恶性肿瘤恶液质42例临床观察[J]. 天津中医药, 2017, 34(4): 236-238. ZHUGE J Z, YI D, ZHANG Y. Clinical observation of Xiaoyan Decoction in treatment of 42 patients with Cachexia of the late malignant tumor[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 236-238. |
| [12] |
LI C, ZHENG X, HAN Y Y, et al. XAV939 inhibits the proliferation and migration of lung adenocarcinoma A549 cells through the WNT pathway[J]. Oncology Letters, 2018, 15(6): 8973-8982. |
| [13] |
PLUMMER R, DUA D, CRESTI N, et al. First-in-human study of the PARP/tankyrase inhibitor E7449 in patients with advanced solid tumours and evaluation of a novel drug-response predictor[J]. British Journal of Cancer, 2020, 123(4): 525-533. |
| [14] |
NORUM J H, SKARPEN E, BRECH A, et al. The tankyrase inhibitor G007-LK inhibits small intestine LGR5+stem cell proliferation without altering tissue morphology[J]. Biological Research, 2018, 51(1): 3. |
| [15] |
MIZUTANI A, YASHIRODA Y, MURAMATSU Y, et al. RK-287107, a potent and specific tankyrase inhibitor, blocks colorectal cancer cell growth in a preclinical model[J]. Cancer Science, 2018, 109(12): 4003-4014. |
| [16] |
OKAMOTO K, OHISHI T, KUROIWA M, et al. MERIT40-dependent recruitment of tankyrase to damaged DNA and its implication for cell sensitivity to DNA-damaging anticancer drugs[J]. Oncotarget, 2018, 9(88): 35844-35855. |
| [17] |
WU Q, XUAN Y F, SU A L, et al. TNKS inhibitors potentiate proliferative inhibition of BET inhibitors via reducing β-Catenin in colorectal cancer cells[J]. American Journal of Cancer Research, 2022, 12(3): 1069-1087. |
| [18] |
HUANG J H, QU Q, GUO Y, et al. Tankyrases/β-catenin signaling pathway as an anti-proliferation and anti-metastatic target in hepatocarcinoma cell lines[J]. Journal of Cancer, 2020, 11(2): 432-440. |
2. National Clinical Research Center for Chinese MedicineAcupuncture and Moxibustion, Tianjin 300381, China
 2022, Vol. 39
2022, Vol. 39